
Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Hondsdolheid bij kinderen
Medisch expert van het artikel
Laatst beoordeeld: 04.07.2025
Hondsdolheid, of hondsdolheid, is een acute virusziekte die wordt overgedragen door de beet van een geïnfecteerd dier. Hierbij treedt schade op aan het zenuwstelsel en kan ernstige encefalitis ontstaan met een fatale afloop.
Epidemiologie
Het rabiësvirus, een plaag voor de volksgezondheid sinds de oudheid, veroorzaakt momenteel jaarlijks ongeveer 59.000 sterfgevallen onder mensen, waarvan bijna alle worden overgedragen door hondenbeten. Dit heeft een aanzienlijke economische impact op ontwikkelingslanden, met name in Afrika en Azië, waar dergelijke verliezen het geringst zijn. Ondanks het sterftecijfer van bijna 100% is hondsdolheid bij honden echter een volledig te voorkomen ziekte, en historische voorbeelden van de uitroeiing van hondsdolheid bij honden in de ontwikkelde wereld getuigen hiervan. [ 1 ]
Oorzaken hondsdolheid
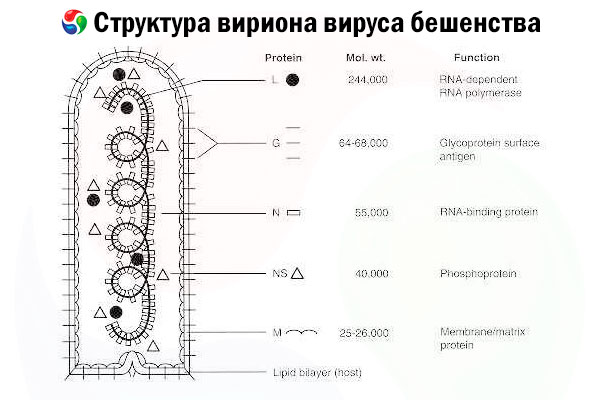
De veroorzaker is het rabiësvirus (RV), een negatief-strengs RNA-virus uit de rhabdovirusfamilie, ongeveer 60 nm × 180 nm groot.
Het bestaat uit een binnenste eiwitkern, of nucleocapside, die nucleïnezuur bevat, en een buitenmembraan, een lipidebevattende dubbellaag bedekt met transmembraan glycoproteïne-spikes. Het heeft een relatief eenvoudige modulaire genoomstructuur en codeert voor vijf structurele eiwitten:
- RNA-afhankelijke RNA-polymerase (L),
- nucleoproteïne (N),
- gefosforyleerd eiwit (P),
- matrixproteïne (M) en
- buitenste oppervlakteglycoproteïne (G).
De N-, P- en L-eiwitten vormen samen met het genomische RNA het ribonucleoproteïnecomplex. G is het enige RV-antigeen dat in staat is de productie van RV-neutraliserende antilichamen te induceren, wat de belangrijkste immuuneffectoren zijn tegen dodelijke RV-infectie. Aan de andere kant is aangetoond dat het ribonucleoproteïnecomplex het belangrijkste RV-antigeen is dat in staat is CD4+-T-cellen te induceren, wat de productie van RV-neutraliserende antilichamen kan versterken door intrastructurele antigeenherkenning.[ 2 ] Het ribonucleoproteïnecomplex kan een belangrijke rol spelen bij het tot stand brengen van immunologisch geheugen en immuniteit op de lange termijn.[ 3 ]
Classificatie en antigeentypen
Het geslacht Lyssavirus omvat het rabiësvirus en antigeen en genetisch verwante rabiësvirussen: Lagos-, Mokola- en Duvenhage-vleermuisvirussen, evenals twee veronderstelde subtypes van Europese vleermuislyssavirussen. Kruisbeschermingsstudies wijzen uit dat dieren die geïmmuniseerd zijn met traditionele rabiësvaccins mogelijk niet volledig beschermd zijn tegen besmetting met andere lyssavirussen.
Rabiësvirussen kunnen worden geclassificeerd als gefixeerd (aangepast door passage in dieren of celculturen) of straat (wildtype). Het gebruik van monoklonale antilichamen en genetische sequentiebepaling om straatrabiësvirussen te differentiëren heeft geholpen bij het identificeren van virale varianten afkomstig uit belangrijke gastheerreservoirs wereldwijd en bij het suggereren van waarschijnlijke bronnen van menselijke blootstelling wanneer een geschiedenis van een definitieve dierenbeet anderszins afwezig was bij een patiënt.[ 8 ]
Pathogenese
De belangrijkste bron van infectie bij wilde dieren zijn wolven, vossen, jakhalzen, vleermuizen, en bij huisdieren - honden en katten, zelden - paarden, runderen, varkens, ratten, enz. Overdracht van mens op mens is, hoewel mogelijk, uiterst zeldzaam. Dit is een typische zoönotische infectie. Mensen raken voornamelijk via honden met hondsdolheid besmet.
Nadat een mens door een ziek dier is gebeten, vermenigvuldigt het virus zich in het spierweefsel op de plaats van de beet en verspreidt zich vervolgens, nadat het de uiteinden van de sensorische perifere zenuwen heeft bereikt, centripetaal naar de motorneuronen. De tijd die het virus nodig heeft om zich te verplaatsen en de hersenen aan te tasten, hangt af van de plaats van de beet. Bij ernstige beten van het hoofd en gezicht kan het virus het centrale zenuwstelsel binnen 15-20 dagen bereiken, en bij lichte schade aan de huid van de romp en ledematen en als gevolg daarvan een kleine dosis van de ziekteverwekker, kan de verplaatsing van het virus naar het centrale zenuwstelsel enkele maanden of zelfs 1-1,5 jaar worden vertraagd. Nadat het virus het centrale zenuwstelsel heeft bereikt, hecht het zich vast in de weefsels van de hersenen en het ruggenmerg, voornamelijk in de neuronen van de medulla oblongata, de hoorn van Ammon en de hersenbasis. In het ruggenmerg worden de achterste hoorns het meest aangetast. Vanuit het centrale zenuwstelsel bereikt het virus via centrifugaalwegen langs de zenuwbanen de speekselklieren, waar het zich vermenigvuldigt en met het speeksel wordt uitgescheiden.
Begrippen in de pathogenese van hondsdolheid
RV heeft een breed scala aan gastheren en kan bijna alle zoogdieren infecteren. Hoewel er verschillende routes van RV-overdracht zijn gerapporteerd, vindt natuurlijke infectie het vaakst plaats via een beet. Naast beten kan consumptie van met RV geïnfecteerde kadavers een infectie met het rabiësvirus bij poolvossen bevorderen, en contact van RV met slijmvliezen is een andere mogelijke transmissieroute gebleken.[ 9 ] In sommige ongewone omstandigheden, zoals het per ongeluk vrijkomen van RV als aerosol in een laboratorium of RV als aerosol in grotten bewoond door grote aantallen vleermuizen,[ 10 ] kan aerosoloverdracht plaatsvinden.
Het is nog niet duidelijk of straat-RV en muis-aangepaste of weefselkweek-aangepaste RV-stammen repliceren op de plaats van inoculatie voordat ze het CZS binnendringen. Terwijl experimentele intramusculaire infectie van jonge hamsters of wasberen met straat-RV RV-replicatie in dwarsgestreepte spiercellen onthulde voordat het virus motorneuronaxonen over neuromusculaire verbindingen binnendrong,[ 11 ],[ 12 ] toonde intramusculaire infectie van muizen met muis-aangepast CVS-24 RV aan dat RV rechtstreeks naar het CZS migreert zonder voorafgaande replicatie op de plaats van inoculatie.[ 13 ] Eenmaal in de uiteinden van ongemyeliniseerde axonen, wordt RV retrograad getransporteerd naar het cellichaam.
Recente bevindingen suggereren dat axonaal vesikeltransport een belangrijke strategie kan zijn voor langeafstandsvirionbeweging in axonen.[ 14 ] Er is geschat dat RV binnen axonen migreert met een snelheid van 3 mm/u.[ 15 ] De infectie verspreidt zich vervolgens via een keten van neuronen die verbonden zijn door synaptische verbindingen. Het exacte mechanisme dat transsynaptische verspreiding bevordert, is echter nog steeds onbekend. Na infectie van de hersenen verspreidt het virus zich centrifugaal naar het perifere en autonome zenuwstelsel in veel perifere organen.[ 16 ] In de laatste fase van de infectiecyclus migreert RV naar de speekselklieren; na replicatie in mucogene acinaire cellen wordt het vrijgegeven in speeksel en is het klaar voor overdracht naar de volgende gastheer.[ 17 ]
Nederlands Met betrekking tot door het rabiësvirus geïnduceerde pathologie is apoptotische celdood voorgesteld als een mogelijk pathogeen mechanisme in experimentele rabiësmodellen van muizen die geïnfecteerd waren met een vaste stam van RV.[ 18 ] Een pathogeen mechanisme dat kan bijdragen aan de ernstige disfunctie van het centrale zenuwstelsel die kenmerkend is voor rabiës, kan een verstoorde neuronale functie zijn. Er is aangetoond dat de genexpressie aanzienlijk verminderd is in RV-geïnfecteerde neuronen, wat resulteert in een algemene onderdrukking van de eiwitsynthese,[ 19 ] en verschillende onderzoeken hebben een verstoorde neurotransmissie aangetoond na RV-infectie. Jiang toonde aan dat de binding van een acetylcholine-receptorantagonist aan geïnfecteerde rattenhersenhomogenaten verminderd was vergeleken met controles.[ 20 ] Een verstoorde afgifte en binding van serotonine, een neurotransmitter die betrokken is bij de controle van de slaapcyclus, pijnperceptie en gedrag, werd ook waargenomen in RV-geïnfecteerde rattenhersenen. [ 21 ], [ 22 ] Naast het beïnvloeden van de neurotransmissie kan een infectie van het rechterventrikel ook ionkanalen beïnvloeden. Geïnfecteerde muizenneuroblastoomcellen vertonen een verminderde functionele expressie van spanningsafhankelijke natriumkanalen, wat actiepotentialen kan verhinderen en uiteindelijk kan leiden tot functionele beperkingen. [ 23 ]
Nederlands Naast de afwezigheid van ernstige pathologische laesies in het CZS, veroorzaken de meeste gevallen van hondsdolheid bij mensen geen immuunreactie 7 tot 10 dagen na het begin van klinische verschijnselen. Deze grote verschillen tussen de pathogenese van hondsdolheid en die van de meeste andere virale of bacteriële infecties van het CZS worden verder ondersteund door het feit dat immunosuppressie ofwel ineffectief ofwel schadelijk is voor de uitkomst van hondsdolheid.[ 24 ] Het lage niveau van immuunreactie dat vaak wordt waargenomen bij slachtoffers van hondsdolheid is raadselachtig omdat het niet kan worden verklaard door de slechte immunogeniciteit van RV-antigenen. RV G en nucleocapside-eiwit zijn namelijk krachtige B- en T-celantigenen wanneer ze parenteraal worden toegediend. [ 25 ] Een mogelijke verklaring voor de lage mate van immuunreactie tegen RV bij mensen of dieren met hondsdolheid kan zijn dat RV-infectie van het CZS immunosuppressie veroorzaakt, [ 26 ] en er is voorgesteld dat RV een subversieve strategie gebruikt, waaronder het voorkomen van apoptose en het vernietigen van binnendringende T-cellen. [ 27 ]
Verzwakte RV-stammen die zijn aangepast aan niet-neuronale cellen verschillen aanzienlijk van pathogene straat-RV-stammen in hun neuroinvasiviteit, wat verwijst naar hun vermogen om het CZS vanuit perifere locaties binnen te dringen. In dit opzicht hebben aan weefselkweek aangepaste RV-stammen ofwel geen ofwel slechts beperkt vermogen om het CZS vanuit perifere locaties binnen te dringen, terwijl straat-RV-stammen of aan muizen aangepaste RV-stammen zoals CVS-24 zeer invasief zijn.[ 28 ] Belangrijke factoren die betrokken zijn bij RV-neuro-invasie zijn onder meer virale opname, axonaal transport, transsynaptische verspreiding en virale replicatiesnelheid.
Tot voor kort was onze kennis over de pathogenese van RV beperkt en voornamelijk gebaseerd op beschrijvende studies van straat-RV-stammen of experimentele infecties met verzwakte stammen die in het laboratorium waren aangepast. De komst van reverse genetics-technologie heeft ons in staat gesteld de virale elementen te identificeren die het pathogene fenotype van RV bepalen en de mechanismen die betrokken zijn bij de pathogenese van rabiës beter te begrijpen.
Identificatie van virale elementen die de verwerving, verspreiding en replicatie van het rabiësvirus controleren
- Virale elementen betrokken bij virusvangst
Nederlands RV-infectie begint met hechting van het virus aan een veronderstelde cellulaire receptor. Hoewel verschillende moleculen van het membraanoppervlak zijn voorgesteld als RV-receptoren, waaronder de nicotine-acetylcholinereceptor,[ 29 ] het neurale celadhesiemolecuul[ 30 ] en de lage-affiniteit neurotrofinereceptor p75 NTR,[ 31 ] is het nog steeds onduidelijk of deze moleculen daadwerkelijk een rol spelen in de levenscyclus van het rabiësvirus. In deze context is onlangs aangetoond dat de RV G–p75 NTR-interactie niet vereist is voor RV-infectie van primaire neuronen.[ 32 ] Na receptorbinding wordt RV geïnternaliseerd via adsorptieve of receptor-gemedieerde endocytose. [ 33 ] De lage pH-omgeving binnen het endosomale compartiment induceert vervolgens conformationele veranderingen in RV G die de fusie van het virale membraan met het endosomale membraan veroorzaken, waardoor de RNP in het cytoplasma wordt vrijgegeven. [ 34 ] Voor virussen speelt RV G een cruciale rol bij de virale opname, hoogstwaarschijnlijk via interacties met veronderstelde cellulaire receptoren die een snelle opname mogelijk maken. In dit opzicht is aangetoond dat de pathogeniciteit van aan weefselkweek aangepaste RV-stammen (bijv. ERA, HEP en CVS-11) correleert met de aanwezigheid van een determinant gelegen in antigene plaats III van het G-eiwit. [ 35 ] Een Arg → Gln-mutatie op positie 333 in deze antigene plaats van het ERA G-eiwit resulteerde in een zevenvoudige vertraging in de internalisatie van de Gln333 RV-variant in vergelijking met de wildtype variant. De Asn194→Lys194-mutatie in RV G, die het opnieuw opduiken van het pathogene fenotype verklaart, werd geassocieerd met een significante afname van de internalisatietijd.[ 36 ] Bovendien lieten experimenten met chimere RV's zien dat de tijd die nodig was voor internalisatie van RV-virionen significant toenam en de pathogeniciteit sterk afnam na vervanging van het G-gen van de zeer pathogene SB RV-stam, die was afgeleid van een cDNA-kloon van de van zilver afgeleide vleermuis-geassocieerde stam RV-18,[ 37 ] met dat van de zeer verzwakte SN-stam, die was geïsoleerd uit een cDNA-kloon van de SAD B19 RV-vaccinstam.[ 38 ] Samen ondersteunen deze gegevens het idee dat de kinetiek van de virusopname, die een functie is van RV G, een belangrijke bepalende factor is voor de pathogeniciteit van RV.
- Virale elementen die betrokken zijn bij de verspreiding en overdracht van virussen
Een unieke eigenschap van het rabiësvirus is zijn vermogen om zich van cel tot cel te verspreiden. De observatie dat de Gln333 ERA-variant pH-afhankelijke cel-cel fusie-activiteit in vitro verliest [ 39 ] en een sterk verminderd vermogen vertoont om zich van cel tot cel te verspreiden [ 40 ] suggereert dat RV G ook een sleutelrol speelt in de verspreiding van cel tot cel en dus de virustransmissie, waarschijnlijk via zijn fusie-activiteit. Deze mogelijkheid wordt verder ondersteund door de bevinding dat de verspreidingssnelheid van de pathogene RV-revertante SPBNGAK bijna twee keer zo hoog is als die welke is vastgesteld voor de niet-pathogene SPBNGA-variant. Interessant is dat de Asn 194 → Lys 194-mutatie in G SPBNGAK een verschuiving veroorzaakte van de pH-drempel voor membraanfusie naar een hogere pH, wat de hypothese ondersteunt dat een hogere pH-drempel voor membraanfusie verband houdt met een verhoogde virusverspreiding. [ 41 ]
Nederlands Studies van transneuronale indicatoren van RV-infectie bij ratten [ 42 ] en resusapen [ 43 ] hebben aangetoond dat het rabiësvirus uitsluitend in retrograde richting migreert in axonen. Hoewel verschillende RV-eiwitten betrokken zijn bij neuronale transportmechanismen, lijkt RV G een overheersende rol te spelen bij de transneuronale verspreiding van RV-infectie. Terwijl perifere infectie met equine infectieuze anemievirus (EIAV) gepseudotypeerd met RV G bijvoorbeeld resulteert in virale overdracht naar het ruggenmerg, kon hetzelfde EIAV gepseudotypeerd met vesiculair stomatitisvirus G het zenuwstelsel niet binnendringen. [ 44 ] Bovendien werd gevonden dat de virale verspreiding van de ERA G Arg 333 → Gln 333 mutant in het CZS sterk verminderd was vergeleken met de wildtype mutant, wat verder suggereert dat intact RV G een functie heeft bij transsynaptische verspreiding. Nederlands Echter, het meest overtuigende bewijs voor een belangrijke rol van RV G in trans-synaptisch transport komt van intracraniële infectie van muizen met een recombinant G-deficiënt RV-virus, wat aantoonde dat de infectie beperkt bleef tot neuronen op de plaats van inoculatie zonder enig bewijs van verspreiding naar secundaire neuronen.[ 45 ] Het is echter waarschijnlijk dat naast RV G, RV M ook een rol speelt in de verspreiding van het virus en dus in het trans-synaptische transport. In dit opzicht werd aangetoond dat de verspreiding van de chimere SN-BMBG RV-variant, die zowel M als G van het zeer pathogene SB bevat, aanzienlijk hoger was dan de verspreiding van de chimere SN-BG- of SN-BM-variant, die respectievelijk de G en M van SB bevatten, wat suggereert dat optimale interactie van M met G een belangrijke rol kan spelen in de verspreiding van cel-tot-cel virus. [ 46 ] Omdat RV M virusknopvorming ondersteunt, [ 47 ] is het waarschijnlijk dat de efficiëntere verspreiding van de RV SN-BMBG chimere variant te danken is aan optimale virusknopvorming bij het postsynaptische membraan.
Uit recente onderzoeken is gebleken dat de interactie tussen RV P en de dyneïne-lichtketen de RV RNP verbindt met het transportsysteem van de gastheercel, waardoor retrograde axonaal transport van het virus wordt gefaciliteerd.[ 48 ],[ 49 ] Uit perifere infectie van volwassen muizen is echter gebleken dat deletie van het LC8-bindingsdomein van RV P de toegang van het virus tot het centrale zenuwstelsel niet verhindert, wat suggereert dat het RV-eiwit niet rechtstreeks betrokken is bij de retrograde axonale verspreiding van RV.[ 50 ]
- Virale elementen die de virale replicatie controleren
In tegenstelling tot veel andere virussen, zoals het influenzavirus, is de pathogeniciteit van RV omgekeerd evenredig met de snelheid van virale RNA-synthese en de productie van infectieuze virale deeltjes. Vergelijking van viraal mRNA en genomische RNA-niveaus geproduceerd door verschillende chimere virussen suggereert dat virale RNA-transcriptie en -replicatie worden gereguleerd door meerdere factoren, waaronder RV M, dat is geïdentificeerd als een trans-werkende factor die de overgang bemiddelt van aanvankelijk hoge niveaus van mRNA-synthese naar genomische RNA-synthese.[ 51 ] Bovendien is M van alle rhabdovirussen in staat virale genexpressie uit te schakelen door zich te binden aan de RNP, wat resulteert in de vorming van een zeer gecondenseerde ruggengraatachtige structuur die geen RNA-synthese kan ondersteunen.
Om andere virale elementen te identificeren die de pathogeniciteit controleren door virale replicatie te reguleren, werden de 5'-terminale sequenties van de zeer pathogene SB-stam stapsgewijs vervangen door sequenties van de sterk verzwakte SN-vaccinstam. Dit resulteerde in de recombinante virussen SB2 (terminale sequentie [TS] + L), SB3 (TS + L + pseudogen [Ψ]), SB4 (TS + L + Ψ + G) en SB5 (TS + L + Ψ + G + M). Intramusculaire infectie met de ouderlijke SB- en SN-virussen en de chimere RV's SB2, SB3, SB4 en SB5 veroorzaakte de hoogste mortaliteit bij met SB geïnfecteerde muizen en geen morbiditeit of mortaliteit bij met SN geïnfecteerde muizen. Vervanging van TS, L en SB door de corresponderende elementen uit SN resulteerde in een bescheiden vermindering van de morbiditeit en mortaliteit, en een extra G- of G plus M-uitwisseling verminderde of deed de virale pathogeniciteit sterk verdwijnen.
Fenotypische karakterisering van deze wildtype en chimere RV's in weefselkweek toonde aan dat de pathogeniciteit van een bepaalde RV omgekeerd gecorreleerd is met zijn vermogen om te repliceren in neuronale cellen. Hoewel SB repliceerde op niveaus die bijna 1000 keer lager waren dan SN, en vervanging van TS, L en in SB door SN-niveaus weinig effect had op de virale groeikinetiek, resulteerde extra vervanging van de G of G plus M van SB door de corresponderende SN-genen in een toename van 1 log in de virusproductie. Dit suggereert dat de virale RNA-replicatiekinetiek en de productie van virale deeltjes grotendeels worden gereguleerd door het RV G-eiwit. Deze conclusie wordt ondersteund door gegevens verkregen met RV G-varianten die één aminozuur verschillen in hun G-eiwitten. De pathogene rabiësvirusvariant SPBNGAK 194 produceerde een virustiter in NA-cellen die 1 log lager was dan die geproduceerd door de niet-pathogene variant SPBNGAN 194, en real-time PCR-analyse toonde aan dat de snelheden van virale RNA-transcriptie en -replicatie in met SPBNGAK geïnfecteerde NA-cellen 5 en 10 keer hoger waren dan in met SPBNGAK geïnfecteerde NA-cellen.[ 52 ] Verder bewijs voor een omgekeerde correlatie tussen pathogeniciteit en de snelheid van virale RNA-synthese en productie van virale deeltjes werd geleverd door muizen geïnfecteerd met chimere recombinante virussen waarin de G- en M-genen van de verzwakte SN-stam werden vervangen door die van de zeer pathogene SB-stam. Deze experimenten onthulden een significante toename van de pathogeniciteit van de ouderlijke SN-stam die RV G droeg ten opzichte van de pathogene SB-stam. De pathogeniciteit werd verder verhoogd wanneer zowel G als M van SB in SN werden geïntroduceerd.
Substitutie van G of M of beide in SN met de corresponderende genen van SB werd geassocieerd met een significante afname van de snelheid van virale deeltjesproductie en de snelheid van virale RNA-synthese. Deze gegevens geven aan dat zowel G als M een belangrijke rol spelen in de pathogenese van RV door virale replicatie te reguleren. De bevinding dat substitutie van G of G plus M in SN met G of G plus M van SB resulteert in een matige tot sterke afname van virale RNA-transcriptie en -replicatie, respectievelijk, terwijl substitutie van M alleen in SN met M van SB resulteert in een sterke toename van virale RNA-transcriptie en -replicatie, geeft aan dat RV G ook een belangrijke regulerende functie heeft in virale RNA-transcriptie/-replicatie, alleen of via interactie met het M-eiwit. Het mechanisme waarmee het RV G-gen de virale RNA-synthese reguleert, is onbekend. Bepaalde nucleotidesequenties binnen de RV G-genen, zoals die met de codons voor Arg333 en Lys 194, zijn geïdentificeerd als targets voor cellulaire miRNA's. Uit onderzoek is gebleken dat doelwitherkenning door cellulaire miRNA's kan resulteren in positieve of negatieve regulatie van de virale replicatie. [ 53 ] Arg 333 → Glu 333 of Lys 194 → Ser 194 substituties binnen de RV G gen-sequentie resulteren in de afschaffing van miRNA doelwit-sequenties, wat op zijn beurt geassocieerd wordt met een significante toename van de snelheid van virale RNA-synthese [Faber M, Thomas Jefferson University, PA, VS, ongepubliceerde gegevens], wat suggereert dat gastheer cellulaire miRNA's ook een belangrijke rol spelen in de regulatie van RV-replicatie, zoals is aangetoond voor andere RNA-virussen waaronder het vesiculair stomatitisvirus en HCV. [ 54 ], [ 55 ]
Regulering van virale replicatie lijkt een van de belangrijke mechanismen te zijn die betrokken zijn bij de pathogenese van RV. Om de immuunrespons te ontwijken en de integriteit van het neuronale netwerk te behouden, kunnen pathogene RV-stammen, maar niet verzwakte stammen, hun groeisnelheid reguleren. Een lagere replicatiesnelheid is waarschijnlijk gunstig voor pathogene RV-stammen, omdat de neuronale structuur die deze virussen gebruiken om het centrale zenuwstelsel te bereiken, behouden blijft. Een andere verklaring voor de lagere replicatiesnelheid van pathogene RV is dat het virus, om vroege detectie door het immuunsysteem van de gastheer te ontwijken, minimale expressieniveaus van zijn antigenen handhaaft.
Relatie tussen RV G-expressie, apoptose en pathogeniciteit
Het is bekend dat stammen van het straatrabiësvirus die aanzienlijk pathogener zijn dan aan weefselkweek aangepaste stammen, zeer beperkte niveaus van G tot expressie brengen en pas laat in de infectieuze cyclus apoptose induceren, wat suggereert dat de pathogeniciteit van een bepaalde virusstam omgekeerd gecorreleerd is met RV G-expressie en het vermogen om apoptose te induceren.[ 56 ] Direct bewijs voor een correlatie tussen het niveau van G-expressie en de mate van apoptose werd verkregen met de recombinante RV SPBNGA-GA, die twee identieke G-genen droeg en RV G overexpresseerde.[ 57 ] Morfologische studies van neuronale culturen geïnfecteerd met deze recombinante RV toonden aan dat celdood significant toenam parallel aan RV G-overexpressie en dat apoptose het belangrijkste mechanisme is dat betrokken is bij RV G-gemedieerde dood. In het bijzonder is de afname van F-actinekleuring na SPBNGA-GA-infectie consistent met apoptose-geïnduceerde depolymerisatie van actinefilamenten. Bovendien was het aantal TUNEL-positieve kernen in SPBNGA-GA-geïnfecteerde neuronen aanzienlijk toegenomen vergeleken met dat in niet-geïnfecteerde en SPBNGA-geïnfecteerde neuronen. Het mechanisme waarmee het RV G-gen het apoptotische signaleringsproces bemiddelt, blijft echter grotendeels onbekend. Er is gesuggereerd dat RV G-expressie boven een bepaalde drempel het celmembraan ernstig verstoort. Het is zeer waarschijnlijk dat apoptotische cellen niet snel in het CZS worden opgeruimd en daarom secundaire necrose ondergaan. [ 58 ] Aan de andere kant kan RV-infectie en in het bijzonder overexpressie van RV G-eiwit leiden tot pyroptose, een celdoodpad dat vergelijkbaar is met apoptose dat, in tegenstelling tot apoptose, de activering van caspase 1 omvat en daardoor leidt tot necrose. [ 59 ] De mate van necrose of pyroptose die wordt geïnduceerd door RV-infectie speelt waarschijnlijk een cruciale rol bij de inductie van antivirale immuniteit. Terwijl apoptotische cellen hun membraanintegriteit behouden en de aangeboren immuunreactie niet stimuleren, worden necrotische cellen permeabiliseerd en scheiden ze endogene adjuvantia af die een robuuste aangeboren immuunreactie kunnen opwekken. [ 60 ]
Omdat de mate van apoptose/necrose correleert met de immunogeniciteit van RV, is gesuggereerd dat het immuunstimulerende effect van apoptotische/necrotische cellen hoogstwaarschijnlijk bijdraagt aan het ontstaan van een beschermende immuunrespons. Regulering van RV G-expressie is daarom zeer waarschijnlijk een belangrijke factor in de pathogenese van rabiës, omdat het een manier biedt voor de overleving en verspreiding van pathogene RV-varianten in het zenuwstelsel zonder openlijke neuronale schade te veroorzaken en een beschermende immuunrespons op te roepen die infectie zou voorkomen.
RV G-expressie kan worden gereguleerd op het niveau van RNA-synthese, posttranslationeel niveau, of beide. De niveaus van RV G die tot expressie worden gebracht door verschillende RV-chimere varianten blijken te worden weerspiegeld door de snelheid van virale RNA-synthese, wat suggereert dat differentiële regulatie van RV G-expressie door deze varianten het gevolg is van variaties in de snelheid van virale mRNA-transcriptie. Net als bij virale RNA-transcriptiesnelheden, correleert de hoeveelheid RV G die door deze varianten tot expressie wordt gebracht omgekeerd evenredig met virale pathogeniciteit. Aan de andere kant resulteerde infectie van primaire neuronale culturen met de minder pathogene RV-variant CVS-B2c in vier keer hogere niveaus van G-eiwit dan infectie met de zeer pathogene variant CVS-N2c, ondanks de synthese van vergelijkbare niveaus van G-mRNA in beide infecties. Pulse-chase-experimenten toonden aan dat de hogere G-eiwitniveaus in met CVS-B2c geïnfecteerde neuronen grotendeels het gevolg waren van een lagere afbraaksnelheid van het CVS-B2c G-eiwit in vergelijking met het CVS-N2c G-eiwit. Het mechanisme dat leidt tot de snellere proteolytische afbraak van het CVS-N2c G-eiwit moet echter nog worden opgehelderd.
Symptomen hondsdolheid
De incubatietijd voor hondsdolheid bedraagt gemiddeld 30-90 dagen. Bij een massale infectie via grote wonden aan het hoofd en gezicht kan de incubatietijd worden verkort tot 12 dagen. In zeldzame gevallen kan de incubatietijd 1 jaar of langer duren.
Er is sprake van een strikt opeenvolgende afwisseling van drie periodes van de ziekte: prodromaal, excitatie, verlamming.
De prodromale periode begint met het optreden van een zeurende of trekkende pijn op de plaats van de beet, evenals pijn langs de zenuwen. In het gebied van het litteken kan een branderig gevoel, jeuk, soms roodheid en zwelling optreden. De patiënt ervaart algemene malaise, hoofdpijn en misselijkheid. Braken, een stijging van de lichaamstemperatuur tot 37,5-38 °C en symptomen van een progressieve psychische stoornis worden opgemerkt: verhoogde reflexprikkelbaarheid, een onverklaarbaar gevoel van angst, vrees, melancholie. Vaak is de patiënt depressief, geremd, teruggetrokken, weigert te eten, slaapt slecht, klaagt over sombere gedachten en angstaanjagende dromen. De prodromale periode duurt 2-3 dagen, soms verlengt tot 7 dagen. Aan het einde van deze periode kunnen er angstaanvallen optreden met kortdurende ademhalingsproblemen, een gevoel van beklemming op de borst, vergezeld van tachycardie en een versnelde ademhaling.
De periode van opwinding wordt gekenmerkt door het optreden van watervrees: bij een poging tot drinken, en vervolgens bij het zien van water of een herinnering daaraan, ervaart de patiënt een krampachtige spasme van de keelholte en het strottenhoofd, waarbij hij de mok water met een schreeuw weggooit, trillende handen naar voren gooit en zijn hoofd en lichaam achterover gooit. De nek is uitgerekt, een pijnlijke grimas vervormt het gezicht, dat blauw wordt door een spasme van de ademhalingsspieren. De ogen puilen uit, drukken angst uit, smeken om hulp, de pupillen zijn verwijd, inademen is moeilijk. Op het hoogtepunt van de aanval is een hart- en ademhalingsstilstand mogelijk. De aanval duurt enkele seconden, waarna de toestand van de patiënt lijkt te verbeteren. Vervolgens kunnen aanvallen van spasmen van de spieren van het strottenhoofd en de keelholte optreden, zelfs door de beweging van lucht (aerofobie), fel licht (fotofobie) of een hard woord (akoesticofobie). De aanvallen gaan gepaard met psychomotorische agitatie, waarbij de patiënt zich als een "gek" gedraagt. Het bewustzijn is tijdens de aanval troebel, maar klaart op in de interictale periode. Tijdens de agitatieperiode ervaren patiënten, door de verhoogde tonus van het sympathische zenuwstelsel, een sterke toename van speekselvloed (sialorroe) met het onvermogen om speeksel door te slikken vanwege spasmen van de faryngeale spieren. De patiënt spuit speeksel. Sommige patiënten kunnen tekenen van meningisme en zelfs opisthotonus ontwikkelen, en convulsies komen vaak voor. In dit geval verandert het hersenvocht mogelijk niet, maar bij sommige patiënten kan de eiwitconcentratie toenemen en kan het aantal cellen toenemen door lymfocyten.
Zonder adequate behandeling nemen de tekenen van uitdroging toe, worden de gelaatstrekken scherper en neemt het lichaamsgewicht af. De lichaamstemperatuur stijgt tot hoge waarden. Stuiptrekkingen zijn mogelijk. De excitatiefase duurt ongeveer 2-3 dagen, zelden 4-5 dagen. Een fatale afloop treedt meestal op tijdens een van de aanvallen. In zeldzame gevallen overleeft de patiënt het derde stadium van de ziekte.
Tijdens de verlammingsperiode kalmeert de patiënt. De aanvallen van watervrees verdwijnen, de patiënt kan drinken en eten, het bewustzijn is helder. Ondanks het schijnbare welzijn nemen lethargie, apathie en depressie echter toe, verlamming van de ledematen, bekkenklachten en verlamming van de hersenzenuwen treden al snel op. De lichaamstemperatuur stijgt tot 42-43 °C, de bloeddruk daalt en aan het einde van de eerste dag treedt de dood in door verlamming van het cardiovasculaire en ademhalingsstelsel.
In het perifere bloed worden neutrofiele leukocytose en een verhoogd hemoglobine-, erythrocyten- en hematocrietgehalte waargenomen.
Wat zit je dwars?
Vormen
Klinisch gezien worden typische en atypische vormen onderscheiden. Atypische vormen omvatten alle gevallen zonder arousal en hydrofobie. Atypische vormen omvatten bulbaire, cerebellaire, meningo-encefalitische vormen, enz.
Diagnostics hondsdolheid
Detectie van rabiësantigeen, antilichamen, viraal RNA of virusisolatie maakt de diagnose van rabiës mogelijk. Omdat elke individuele test negatief kan zijn bij een patiënt met rabiës, zijn soms seriële serummonsters voor de detectie van rabiësantilichamen, speekselmonsters voor virale kweek en huidbiopten voor directe immunofluorescentietesten op viraal antigeen nodig, vooral wanneer er een sterk vermoeden van rabiës bestaat.
Een van de snelste methoden voor het diagnosticeren van antemortem rabiës bij mensen is het uitvoeren van een directe immunofluorescentietest op een huidbiopsie van de nek om rabiësantigeen te detecteren. De directe immunofluorescentietest is de meest gevoelige en specifieke methode voor het detecteren van rabiësantigeen in de huid en andere verse weefsels (bijv. een hersenbiopsie), hoewel de resultaten in een vroeg stadium van de ziekte soms negatief kunnen zijn. Als er geen vers weefsel beschikbaar is, kan enzymatische vertering van gefixeerd weefsel de reactiviteit van de immunofluorescentietest verhogen; de gevoeligheid kan echter onacceptabel laag zijn.
De diagnose kan ook worden gesteld als het virus wordt geïsoleerd uit speeksel na inoculatie met neuroblastoomcellen of laboratoriumknaagdieren; dit is meestal het meest effectief tijdens de eerste 2-3 weken van de ziekte. Detectie van neutraliserende antilichamen tegen het rabiësvirus, meestal uitgevoerd met de snelle fluorescentie focus inhibitietest (RFFIT), in het serum van niet-gevaccineerde personen is ook diagnostisch. De aanwezigheid van antilichamen in het hersenvocht bevestigt de diagnose, maar deze kunnen 2-3 dagen later verschijnen dan serumantilichamen en zijn daarom mogelijk minder nuttig in de vroege stadia van de ziekte. Hoewel de serologische respons na vaccinatie over het algemeen niet te onderscheiden is van de serologische respons die door de ziekte wordt geïnduceerd, produceert vaccinatie doorgaans geen antilichamen tegen het hersenvocht.
Slechts zeven gevallen van "herstel" van rabiës in de afgelopen 25 jaar zijn goed gedocumenteerd. Hoewel het rabiësvirus bij geen enkele patiënt werd geïsoleerd, ondersteunden hoge titers van rabiësneutraliserende antilichamen in serummonsters en de aanwezigheid van neutraliserende antilichamen in het hersenvocht de diagnose sterk.
Wat moeten we onderzoeken?
Welke tests zijn nodig?
Differentiële diagnose
De diagnose hondsdolheid bij de mens wordt meestal gesteld op basis van epidemiologische en klinische gegevens en in het laboratorium bevestigd. De diagnose is eenvoudig als er sprake is van een voorgeschiedenis van dierenbeten en het volledige spectrum aan symptomen en verschijnselen is opgetreden. Anders is een zorgvuldige maar snelle evaluatie van de epidemiologische en klinische kenmerken van minder typische gevallen noodzakelijk voordat specifieke laboratoriumtests worden uitgevoerd. Elke patiënt met neurologische tekenen of symptomen of onverklaarbare encefalitis dient te worden ondervraagd over de mogelijkheid van blootstelling aan dieren in rabiës-endemische gebieden binnen of buiten het land van verblijf. Het niet vermoeden van hondsdolheid bij verschillende recente menselijke sterfgevallen in de Verenigde Staten kan te wijten zijn aan een gebrek aan zorgvuldige blootstellingsgeschiedenis.
Hondsdolheid kan bij aanvang van de ziekte veel infectieuze en niet-infectieuze ziekten nabootsen. Veel andere encefalitis, zoals die veroorzaakt door herpesvirussen en arbovirussen, lijken op hondsdolheid. Andere infectieziekten kunnen ook hondsdolheid nabootsen, zoals tetanus, cerebrale malaria, rickettsiose en tyfus. Verlammende infectieziekten die verward kunnen worden met hondsdolheid zijn onder andere polio, botulisme en herpes simian B-encefalitis.
Niet-infectieuze aandoeningen die met hondsdolheid kunnen worden verward, zijn onder andere een aantal neurologische syndromen, met name acute inflammatoire polyneuropathie (syndroom van Guillain-Barré), evenals allergische encefalomyelitis na vaccinatie als gevolg van rabiësvaccinatie van het zenuwweefsel, vergiftiging of drugsintoxicatie, alcoholontwenning, acute porfyrie en rabiëshysterie. Het syndroom van Guillain-Barré kan worden verward met paralytische rabiës, en vice versa.
Met wie kun je contact opnemen?
Behandeling hondsdolheid
Er is geen behandeling voor hondsdolheid ontwikkeld. Toediening van hoge doses specifiek antirabiësimmunoglobuline en leukocyteninterferon is niet effectief. Symptomatische behandeling wordt toegepast om het lijden van de patiënt te verlichten. Hiervoor wordt de patiënt in een aparte afdeling of box geplaatst en een beschermend regime gecreëerd dat de invloed van de externe omgeving beperkt (minder lawaai, fel licht, luchtstroom). Om de prikkelbaarheid van het centrale zenuwstelsel te verminderen, worden slaappillen, anti-epileptica en pijnstillers voorgeschreven. De vochtbalans wordt genormaliseerd.
In de paralytische fase worden medicijnen voorgeschreven die de activiteit van het cardiovasculaire en respiratoire systeem stimuleren. Hyperbare oxygenatie, cerebrale hypothermie en gecontroleerde mechanische ademhaling met volledige curarisatie van de patiënt worden aanbevolen. Alle behandelmethoden zijn echter praktisch ineffectief. In het beste geval is het mogelijk het leven van de patiënt met enkele maanden te verlengen. Een ongunstige afloop wordt bepaald door de ernst van de schade aan de hersenstam met de vernietiging van vitale centra.
Het voorkomen
De ontwikkeling van het eerste rabiësvaccin door Pasteur in 1885 luidde een tijdperk in van veel effectievere rabiësbestrijding. Vandaag de dag is de ziekte, ondanks het sterftecijfer van bijna 100% bij mensen door rabiës, volledig te voorkomen door vaccinatie vóór en/of na blootstelling. Terwijl Pasteur en zijn collega's de vaccinatie van privé-honden in Parijs initieerden, werd de eerste massale vaccinatie van honden begin jaren twintig in Japan uitgevoerd, wat het eerste grote nationale rabiësbestrijdingsprogramma markeerde. Orale vaccinatie van wilde dieren, voor het eerst ontwikkeld in de jaren zeventig, is sindsdien herhaaldelijk gebleken de ziekte effectief te bestrijden bij belangrijke terrestrische gastheren zoals vossen, wasberen en stinkdieren.[ 68 ] Aanhoudende rabiësvaccinatie van reservoirdierpopulaties met een dekkingspercentage van 70% of hoger zal uiteindelijk RABV bij reservoirsoorten elimineren en de verspreiding van het virus naar incidentele gastheren voorkomen. [ 69 ]
Fylogenetische gegevens geven aan dat lyssavirussen vleermuizen infecteerden lang voordat ze landzoogdieren infecteerden, en de meeste lyssavirussen, waaronder RABV, circuleren nog steeds in verschillende vleermuissoorten wereldwijd.[ 70 ] Effectieve methoden om de overdracht van RABV onder vleermuizen te voorkomen blijven echter ongrijpbaar, waardoor de mogelijkheid van volledige uitroeiing van hondsdolheid op dit moment wordt uitgesloten. Echter, zelfs na blootstelling aan RABV via de beet van een met hondsdolheid besmet zoogdier, kan veilige en effectieve post-expositie profylaxe (PEP, inclusief wondreiniging, hondsdolheid immuunglobuline en hondsdolheid vaccinatie) mensen beschermen tegen hondsdolheid infectie als de behandeling snel wordt toegediend en volgens de aanbevelingen van de Wereldgezondheidsorganisatie (WHO).
Deze twee methoden om menselijke sterfgevallen te voorkomen – de ene gebaseerd op het vaccineren van blootgestelde mensen en de andere gebaseerd op het vaccineren van voldoende honden om de cyclus van overdracht bij de bron te doorbreken – vormen de bouwstenen van een 'one health'-benadering voor de preventie en bestrijding van hondsdolheid bij honden. Deze twee verschillende manieren om menselijke sterfgevallen te voorkomen werden beschouwd als afzonderlijke alternatieven: Strategie A, gebaseerd op het verstrekken van PEP aan mensen, en Strategie B, gebaseerd op het vaccineren van honden; of als componenten van een gecombineerde Strategie A + B in een analyse van de waarschijnlijke kosten van de alternatieve strategieën.[ 71 ]
Landen als Thailand hebben enorm veel succes gehad met het voorkomen van menselijke sterfgevallen door het gebruik van PEP, maar hebben ook een toenemende vraag en de daarmee gepaard gaande kosten ondervonden die gepaard gaan met het gebruik van PEP alleen. [ 72 ] Vergeleken met de situatie in 1991 hadden bijvoorbeeld in 2003 vier keer zoveel mensen (meer dan 400.000) PEP nodig. Recente gegevens laten zien dat de Volksrepubliek China, waar jaarlijks 15 miljoen mensen worden gevaccineerd na mogelijke blootstelling aan hondsdolheid, jaarlijks ongeveer 650 miljoen Amerikaanse dollars alleen al aan PEP uitgeeft. [ 73 ]
Een veel duurzamere aanpak is om de verspreiding van infectie bij de bron te voorkomen, in de dierenpopulatie, terwijl de toegang tot PEP voor blootgestelde menselijke patiënten wordt vergroot wanneer dat nodig is. Waar er politieke wil en voldoende financiering is om hondsdolheid bij honden te bestrijden, kunnen en zijn sterfgevallen voorkomen. Het wijdverbreide gebruik van hondenvaccinatie heeft geleid tot de eliminatie van hondsdolheid bij honden in verschillende landen, waaronder Maleisië in 1954, [ 74 ] Japan in 1956, Taiwan in 1961, Singapore en met name in heel West-Europa (besproken in Rupprecht et al, King et al, en Gongal en Wright). [ 75 ]


 [
[