
Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Hypofysair microadenoom: oorzaken, symptomen, gevaar, prognose
Medisch expert van het artikel
Laatst beoordeeld: 12.07.2025
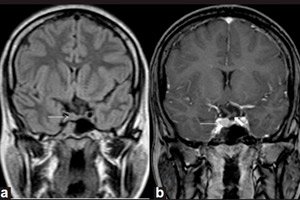
Goedaardige gezwellen die in de endocriene klieren ontstaan, worden adenomen genoemd. Een microadenoom van de hypofyse is een kleine tumor in de voorste kwab van de hypofyse, die een aantal belangrijke hormonen produceert.
Epidemiologie
De incidentie van hypofysetumoren wordt geschat op 10-23%, en hypofyseadenomen, die verschillende vormen en maten kunnen hebben, komen het meest voor (16%).[ 1 ]
Ongeveer 20-25% van de mensen heeft mogelijk kleine hypofysetumoren, microadenomen, zonder dat ze het weten. In ongeveer de helft van de gevallen worden zulke tumoren bij toeval ontdekt tijdens hersenscans.
Prolactine-afscheidende microadenomen vormen 45-75% van dergelijke tumoren; ACTH-producerende tumoren vormen niet meer dan 14% van de gevallen en de frequentie van STH-producerende microadenomen bedraagt niet meer dan 2%.
Bij kinderen en adolescenten wordt bij 10,7-28% van de gevallen een microadenoom van de hypofyse vastgesteld, en minstens de helft daarvan is hormonaal inactief. [ 2 ]
Oorzaken hypofyse microadenomen
Deskundigen kennen de exacte redenen voor het ontstaan van microadenomen in de hypofyse, een endocriene klier in de hersenen waarvan de cellen het volgende produceren:
- corticotropine of ACTH – adrenocorticotroop hormoon, dat de afscheiding van steroïde hormonen door de bijnierschors veroorzaakt;
- groeihormoon STH – somatotroop hormoon;
- gonadotropinen FSH – follikelstimulerend hormoon en LH – luteïniserend hormoon, die de productie van vrouwelijke geslachtshormonen in de eierstokken en mannelijke geslachtshormonen in de testikels bepalen;
- lactogene hormoon prolactine (PRL);
- thyrotropine of schildklierstimulerend hormoon (TSH), dat de synthese van hormonen door de schildklier stimuleert.
Er wordt aangenomen dat de ontwikkeling van deze tumoren het gevolg kan zijn van traumatisch hersenletsel, onvoldoende bloedtoevoer naar de hypofyse, herseninfecties of blootstelling aan gifstoffen (die oedeem en intracraniële hypertensie veroorzaken).
Risicofactoren
Het is bekend dat hypofyse-adenomen en microadenomen vaker voorkomen bij een erfelijke aanleg voor het MEN 1-syndroom - multipele endocriene adenomatose type 1. Er zijn dus genetisch bepaalde risicofactoren die samenhangen met bepaalde veranderingen in het DNA. [ 3 ]
Meervoudige endocriene neoplasie type 4 (MEN4): MEN4 heeft een mutatie in het gen voor cycline-afhankelijke kinase-remmer 1 B (CDKN1B), dat wordt gekenmerkt door hypofysetumoren, hyperparathyreoïdie, neuro-endocriene tumoren van de testikels en de baarmoederhals.[ 4 ]
Carneycomplex (CNC): Bij het Carneycomplex is er sprake van een kiemlijnmutatie in het tumorsuppressorgen PRKAR1A, wat leidt tot primaire gepigmenteerde nodulaire bijnierschorsziekte (PPNAD), testikeltumoren, schildkliernoduli, vlekkerige hyperpigmentatie van de huid en acromegalie.[ 5 ]
De klinische vorm van familiale geïsoleerde hypofyseadenomen (FIPA) wordt gekenmerkt door genetische defecten in het arylhydrocarbon receptor interacting protein (AIP)-gen, in ongeveer 15% van alle verwante en 50% van de homogene somatotropinefamilies.[ 6 ]
Familiale geïsoleerde hypofyseadenomen (FIPA): Een mutatie in het arylhydrocarbon receptor interacting protein (AIP) wordt in de adolescentie of vroege volwassenheid vastgesteld bij ongeveer 15% van alle FIPA-gevallen. Deze tumoren zijn doorgaans agressief en scheiden meestal groeihormoon af, wat acromegalie veroorzaakt.[ 7 ]
Het is niet uitgesloten dat dit type tumor ontstaat als gevolg van functionele stoornissen van andere endocriene klieren en hersenstructuren, in het bijzonder veranderingen in het vaatstelsel van de hypothalamus, dat binnen het neuro-endocriene hypothalamus-hypofysesysteem de werking van de hypofyse en zijn voorste kwab, de adenohypofyse, met zijn hormonenafgevende werking reguleert.
Pathogenese
Histologisch gezien is een hypofyseadenoom een goedaardige tumor. Afhankelijk van de grootte worden deze neoplasmata onderverdeeld in microadenomen (tot 10 mm groot op het breedste punt), macroadenomen (10-40 mm) en reuzenadenomen (40 mm of groter).
Bij het bestuderen van de pathogenese van tumorvorming in de hypofyse was het nog niet mogelijk om de mechanismen te bepalen van de hyperplastische transformatie van cellen van de voorste kwab tot een tumor.
Volgens deskundigen is een van de meest overtuigende verklaringen een verband met de ontregeling van het metabolisme van de neurotransmitter en het hormoon dopamine (de belangrijkste remmer van prolactinesecretie) en/of een verstoring van de functies van transmembraandopaminereceptoren van hypofysecellen die PRL (lactotrofen) afscheiden.
De meeste hypofysemicroadenomen zijn sporadisch, maar sommige komen voor als onderdeel van genetisch bepaalde neuro-endocriene syndromen zoals MEN 1, het syndroom van McCune-Albright, het syndroom van Werner en het syndroom van Carney (of Carneycomplex). Dit laatste syndroom gaat gepaard met een verhoogd risico op het ontwikkelen van goedaardige tumoren in de hormonale (endocriene) klieren, waaronder de hypofyse, de bijnieren, de schildklier, de eierstokken en de testikels.
Symptomen hypofyse microadenomen
Een hypofysemicroadenoom kan lange tijd symptoomloos zijn. De symptomen variëren afhankelijk van de locatie en ontstaan meestal als gevolg van een endocriene disfunctie. Dit is de meest voorkomende bevinding bij een hormonale disbalans die gepaard gaat met een overmatige productie van een of meer hormonen. In de meeste gevallen, per locatie, gaat het om een microadenoom van de hypofysevoorkwab.
Er bestaan verschillende soorten hypofyse-microadenomen op basis van hun hormonale activiteit. Het meest voorkomende type wordt daarom beschouwd als een niet-functionerend adenoom – een hormonaal inactief hypofyse-microadenoom, dat – totdat het een bepaalde grootte bereikt – geen symptomen geeft. Maar een groeiend hormonaal inactief hypofyse-microadenoom kan nabijgelegen hersenstructuren of hersenzenuwen comprimeren, dus een hypofyse-microadenoom en hoofdpijn in de frontale en temporale regio's kunnen gecombineerd worden, [ 8 ] en ook zichtproblemen zijn mogelijk. [ 9 ] Echter, zoals onderzoekers beweren, zijn niet-functionerende (hormonaal inactieve) hypofysetumoren in 96,5% van de gevallen macroadenomen. [ 10 ]
Een hormonaal actief microadenoom van de hypofyse (de voorkwab) met verhoogde secretie van het hormoon prolactine kan ook voorkomen - hypofyseprolactinoom. Een verhoogde productie van PRL door lactotrope cellen van de adenohypofyse wordt gedefinieerd als hyperprolactinemie bij hypofysemicroadenoom.
Hoe manifesteert zo'n hypofyse-microadenoom zich bij vrouwen? Pathologisch hoge niveaus van dit hormoon remmen de productie van oestrogenen, en de eerste tekenen manifesteren zich in menstruatiecyclusstoornissen – met het uitblijven van de menstruatie (amenorroe) en/of de ovulatiefase. Als gevolg hiervan ontwikkelt zich een aanhoudend galactorroe-amenorroesyndroom en gaat de mogelijkheid om zwanger te worden verloren.
Prolactine-secreterende hypofyse-microadenoom bij mannen kan leiden tot hyperprolactinemisch hypogonadisme met een verminderd libido, erectiestoornissen, vergrote borsten (gynaecomastie) en minder gezichts- en lichaamsbeharing.
Actieve microademhaling die corticotropine (ACTH) afscheidt, leidt tot een overmaat aan steroïde hormonen (glucocorticoïden) die door de bijnierschors worden geproduceerd, wat de ziekte van Itsenko-Cushing van de hypofyse kan veroorzaken.
Bij kinderen kan een dergelijk microadenoom zich uiten met verschijnselen van hypercorticisme (syndroom van Cushing), waaronder hoofdpijn, algemene zwakte, overmatige afzetting van vetweefsel op de romp, afname van de botmineraaldichtheid en spierkracht, strookvormige atrofie van de huid (in de vorm van paarse strepen), enz.
Bij een actief somatotropineproducerend microadenoom stijgt de STH-spiegel in het lichaam. Tijdens de kindertijd stimuleert de overmatige anabole werking de groei van bijna alle botten in het lichaam en kan leiden tot gigantisme; bij volwassenen kan acromegalie zich ontwikkelen met een verhoogde groei van de gezichtsbeenderen (wat leidt tot vervorming van het uiterlijk) en kraakbeen in de gewrichten van de ledematen (wat leidt tot een verstoring van hun proporties en verdikking van de vingers), met gewrichtspijn, overmatig zweten en talgafscheiding, en een verminderde glucosetolerantie.
Zeer zelden (in 1-1,5% van de gevallen) is er sprake van een microadenoom van de hypofyse die thyrotropine produceert. Aangezien dit hormoon een stimulerende werking heeft op de schildklier, vertonen patiënten klinische verschijnselen van hypofysaire hyperthyreoïdie in de vorm van sinustachycardie en atriumfibrilleren van het hart, verhoogde bloeddruk, gewichtsverlies (met toegenomen eetlust) en een verhoogde zenuwachtige prikkelbaarheid en prikkelbaarheid.
Het zogenaamde intrasellaire microadenoom van de hypofyse, synoniem - endosellair microadenoom van de hypofyse, is, net als de gehele hypofyse, gelokaliseerd in de sella turcica - binnen de anatomische zadelvormige holte in het wiggenbeen van de schedelbasis. Tegelijkertijd bevindt de hypofyse zich onderin deze holte - in de hypofysefossa (intrasellaire regio). Het hele verschil is dat "binnen" in het Latijn intra betekent en in het Grieks endom.
Bij een hypofyse-microadenoom met suprasellaire groei groeit de tumor vanuit de onderkant van de hypofysefossa naar boven.
Cysteus microadenoom van de hypofyse heeft een gesloten zakachtige structuur en is een asymptomatische formatie.
Microadenoom van de hypofyse met bloeding kan het gevolg zijn van een beroerte of een herseninfarct in verband met vergroting van de klier en beschadiging van de sinusvormige haarvaten van het parenchym van de voorkwab, neurohemale synapsen en/of poortvaten.
Microadenoom van de hypofyse en zwangerschap
Zoals reeds opgemerkt, zijn vrouwen met een prolactineproducerend hypofysemicroadenoom meestal onvruchtbaar vanwege een oestrogeentekort en een onderdrukking van de pulserende secretie van GnRH (gonadotropine-releasing hormone). Om zwanger te kunnen worden, moeten de prolactinespiegels genormaliseerd zijn, anders vindt er geen bevruchting plaats of wordt de zwangerschap al in het begin afgebroken.
- Is het mogelijk om te bevallen met een hypofyse-microadenoom?
Bij vrouwen met klinisch functionerende microadenomen die worden behandeld met dopamine-agonisten (Cabergoline of Dostinex), kunnen de prolactinespiegels normaliseren en kunnen de menstruatiecycli en de vruchtbaarheid worden hersteld.
Is borstvoeding mogelijk met een hypofyse-microadenoom?
In de postpartumperiode is borstvoeding toegestaan als er geen symptomen van de tumor zijn, maar de grootte ervan moet wel in de gaten worden gehouden (met behulp van MRI van de hersenen). En als de tumor groeit, wordt de borstvoeding stopgezet.
- Microadenoom van de hypofyse en IVF
Behandeling van hyperprolactinemie is noodzakelijk bij IVF. De procedure kan worden gestart als de normale prolactinespiegels gedurende 12 maanden stabiel zijn en er geen afwijkingen zijn in de serumspiegels van andere hypofysehormonen.
Complicaties en gevolgen
Wat is er gevaarlijk aan hypofyse-microadenoom? Hoewel deze tumor goedaardig is, kan de aanwezigheid ervan complicaties en gevolgen veroorzaken, met name:
- leiden tot een disfunctie van het hypothalamus-hypofyse-bijniersysteem met de ontwikkeling van de ziekte van Itsenko-Cushing;
- de hormonale regulatie van de menstruatiecyclus bij vrouwen verstoren en bij mannen tot erectiestoornissen leiden;
- groeiachterstand en hypofysaire dwerggroei (hypopituïtarisme) bij kinderen veroorzaken;
- de ontwikkeling van osteoporose veroorzaken.
Wanneer een groeiende tumor de oogzenuwvezels beknelt in het gebied waar ze elkaar kruisen (wat bij 80% van de mensen direct boven de hypofyse ligt), treedt er een verstoring van de oogmobiliteit (oftalmoplegie) op en een geleidelijke verslechtering van het perifere zicht. Microadenomen zijn echter meestal te klein om een dergelijke druk uit te oefenen.
Kan een hypofyse-microadenoom genezen? Het kan niet genezen, maar na verloop van tijd kan een hormonaal inactieve tumor bij kinderen aanzienlijk kleiner worden. Bij ongeveer 10% van de patiënten kunnen microadenomen echter in omvang toenemen.
Diagnostics hypofyse microadenomen
Om een hypofyse-microadenoom te diagnosticeren, zijn een volledige anamnese en laboratoriumonderzoeken nodig: bloedonderzoek naar hormoonspiegels (geproduceerd door de hypofyse), inclusief een radioimmunoassay van het bloedserum naar prolactinespiegels.
Als de prolactinespiegel normaal is bij een hypofyse-microadenoom, is deze tumor hormonaal inactief. Maar als er symptomen van een prolactinoom zijn, kan een dergelijke vals-negatieve uitslag het gevolg zijn van een fout in de laboratoriumtest of van een macroadenoom dat de hypofysesteel comprimeert.
Daarnaast kunnen aanvullende onderzoeken nodig zijn, bijvoorbeeld naar de hoeveelheid schildklierhormonen (T3 en T4), immunoglobulinen en interleukine-6 in het bloedserum.
Microadenomen kunnen alleen worden opgespoord door instrumentele diagnostiek met behulp van magnetische resonantiebeeldvorming (MRI) van de hersenen. MRI voor microadenomen wordt beschouwd als de standaard voor visualisatie, met een sensitiviteit van 90% bij MRI met contrastversterking.
MRI-tekenen van hypofyse-microadenoom omvatten: volume van de klier aan de kant van het microadenoom; een toename van de grootte van de sella turcica; verdunning en veranderingen in de contouren van de fundus (onderwand); laterale afwijking van het infundibulum van de hypofyse; iso-intensiteit van het ronde gebied vergeleken met de grijze stof op T1- en T2-gewogen beelden; lichte hyperintensiteit op T2-gewogen beelden. [ 11 ]
Differentiële diagnose
Differentiële diagnostiek wordt verricht bij craniofaryngioom, granulocellulaire tumor (choristoom) van de hypofyse, Rathke-zakjescyste, dermoïdvorming, ontsteking van de hypofyse - auto-immuun of lymfocytaire hypofysitis, feochromocytoom, schildklieraandoeningen, etc.
Bij vrouwen met een anovulatoire cyclus worden hypofysair microadenoom en polycysteus ovariumsyndroom onderscheiden, aangezien 75-90% van de gevallen van uitblijven van ovulatie een gevolg zijn van polycysteus ovariumsyndroom.
Met wie kun je contact opnemen?
Behandeling hypofyse microadenomen
Bij hypofyse-adenomen en microadenomen kan de behandeling medicamenteus en chirurgisch zijn. Als de tumoren asymptomatisch zijn, is het raadzaam om ze te monitoren, dat wil zeggen regelmatig een MRI te laten maken, om het begin van hun vergroting niet te missen.
Het voorschrijven van een bepaald medicijn hangt af van het type tumor dat de patiënt heeft.
Farmacotherapie van tumoren die PRL afscheiden, wordt uitgevoerd met geneesmiddelen uit de groep van stimulatoren van dopamine D2-receptoren van de hypothalamus (selectieve dopamine-agonisten). De meest gebruikte geneesmiddelen zijn Bromocriptine (Parlodel, Bromergol), Norprolac en het moederkoorderivaat Cabergoline of Dostinex voor hypofyse-microadenoom met verhoogde prolactinesecretie.
Bijwerkingen van Dostinex (Cabergoline) kunnen zijn: allergische reacties; hoofdpijn en duizeligheid; misselijkheid, braken en buikpijn; constipatie; een gevoel van zwakte of vermoeidheid; slaapstoornissen. Tot de bijwerkingen van Bromocriptine (naast allergische reacties) behoren pijn op de borst; een verhoogde hartslag en ademhaling met een gevoel van kortademigheid; het ophoesten van bloed; verslechtering van de bewegingscoördinatie, enz.
De geneesmiddelen Octreotide (Sandostatine), Lanreotide (Somatuline) en Pegvisomant, die worden gebruikt bij micro- en macroadenomen die groeihormoon afscheiden, zijn remmers van STH en antagonisten van de receptoren ervan.
En voor ACTH-producerende neoplasmata van de adenohypofyse met het Itsenko-Cushing-syndroom worden Metyrapon (Metopiron) of Mitotane (Lysodren) gebruikt.
Chirurgische behandeling dient te worden overwogen bij functionerende (hormonaal actieve) microadenomen. In gevallen waarin conservatieve behandeling niet effectief is en de tumor een lichte suprasellaire expansie in de sella turcica vertoont, kan hypofyseadenomectomie worden voorgeschreven - een operatie om het hypofysemicroadenoom te verwijderen. Momenteel wordt transnasale of transsfenoïdale microdissectie uitgevoerd, dat wil zeggen verwijdering van het hypofysemicroadenoom via de neus.
Mogelijke complicaties en gevolgen van het verwijderen van het microadenoom van de hypofyse zijn onder meer postoperatieve bloedingen en lekkage van hersenvocht (waarvoor vaak een heroperatie nodig is), maar ook ontsteking van de hersenvliezen, slechtziendheid, vorming van hematomen, voorbijgaande diabetes insipidus en terugkeer van het microadenoom.
Homeopathie voor hypofyse-microadenoom met hyperprolactinemie maakt gebruik van geneesmiddelen waarvan de werking de symptomen gedeeltelijk kan verlichten. Zo worden bij onregelmatige menstruatie en amenorroe een middel op basis van sepia-inkt en een middel op basis van de wildemanskruid Pulsatilla voorgeschreven, en bij galactorroe een middel op basis van de wortel van de Europese cyclaam.
Uiteraard mag men niet hopen dat de traditionele behandeling van hypofyse-microadenoom effectiever is. En niet alleen omdat kruidengeneeskundigen zich bij deze diagnose uitsluitend laten leiden door de klachten van patiënten (zonder de ware oorzaak ervan te kennen), maar ook vanwege de onbetrouwbaarheid van veel "traditionele remedies". Je hoeft niet ver te zoeken voor voorbeelden.
Sommige internetbronnen raden aan om een mengsel van sleutelbloem, gemberwortel en sesamzaad te gebruiken om de prolactinespiegel te verlagen. Sleutelbloem helpt echter bij langdurige droge hoest, verdunt slijm, en gemberwortel vertoont, net als sesamzaad, lactogene eigenschappen.
Je kunt ook advies krijgen om een tinctuur van olibanum te nemen. Maar in werkelijkheid wordt dit middel inwendig gebruikt tegen winderigheid en uitwendig tegen reumatische gewrichtspijn. Waarschijnlijk werd olibanum verward met de wortels van zilverkaars (andere namen zijn zilverkaars en zilverkaars), die gebruikt worden tegen opvliegers tijdens de menopauze.
Voeding voor hypofyse-microadenoom moet evenwichtig zijn - met minder suiker en zout. Dit is geen speciaal dieet, maar gewoon minder calorieën.
Bij hypofyse-microadenoom is alcoholgebruik uitgesloten.
Welke arts moet ik raadplegen voor een hypofyse-microadenoom? Endocrinologen, gynaecologen en neurochirurgen behandelen de problemen die bij dit type tumor voorkomen.
Het voorkomen
Omdat de omgevingsfactoren of levensstijlfactoren die hypofysetumoren veroorzaken, onbekend zijn, is er eenvoudigweg geen manier om de ontwikkeling van hypofysemicroadenomen te voorkomen.
Prognose
De meeste hypofysetumoren zijn te genezen. Als een hormonaal actief hypofysetumoradenoom tijdig wordt ontdekt, is de kans op herstel groot en de prognose gunstig.
Invaliditeit en hypofyse-microadenoom: invaliditeit kan gepaard gaan met tumorgroei en schade aan de oogzenuw, evenals andere gevolgen van deze pathologie, waarvan de ernst individueel verschilt. De erkenning van een patiënt als invalide hangt af van bestaande gezondheidsproblemen en de mate van functionele stoornissen, die moeten voldoen aan wettelijk goedgekeurde criteria.
Hypofyse-microadenoom en het leger: patiënten met deze tumor (zelfs als deze succesvol verwijderd is) mogen zich niet oververhitten, langdurig in de zon blijven en zich fysiek niet overbelasten. Ze zijn daarom niet geschikt voor militaire dienst.
Hoe lang leven mensen met een hypofyse-microadenoom? Deze tumor is geen kanker, dus er zijn geen grenzen aan de levensverwachting. Bij een actief STH-producerend microadenoom kunnen patiënten echter hypertensie en een grotere hartgrootte ontwikkelen, wat hun levensverwachting aanzienlijk kan verkorten. Een verhoogd risico op overlijden bij patiënten ouder dan 45 jaar wordt opgemerkt bij de ziekte van Itsenko-Cushing en acromegalie.

