
Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Wetenschappers hebben een 'kameleonverbinding' gemaakt om resistente hersenkankers te behandelen
Laatst beoordeeld: 02.07.2025
Een nieuw onderzoek door wetenschappers van de Yale Universiteit beschrijft hoe een nieuwe chemische verbinding medicijnresistente hersentumoren aanvalt zonder het gezonde omliggende weefsel te beschadigen.
Het onderzoek, gepubliceerd in het Journal of the American Chemical Society, is een belangrijke stap in de ontwikkeling van zogenaamde 'kameleonverbindingen' die gebruikt kunnen worden in de strijd tegen diverse gevaarlijke vormen van kanker.
Gliomen ontwikkelen zich bij ongeveer 6,6 per 100.000 mensen per jaar en bij 2,94 per 100.000 mensen vóór het 14e levensjaar. Exclusief uitzaaiingen van andere kankersoorten die het centrale zenuwstelsel bereiken, vormen gliomen 26% van alle hersentumoren (primaire hersentumoren) en 81% van alle kwaadaardige hersentumoren.
Patiënten met glioblastoom worden al tientallen jaren behandeld met het medicijn temozolomide. De meeste patiënten ontwikkelen echter binnen een jaar resistentie tegen temozolomide. De vijfjaarsoverleving voor patiënten met glioblastoom is minder dan 5%.
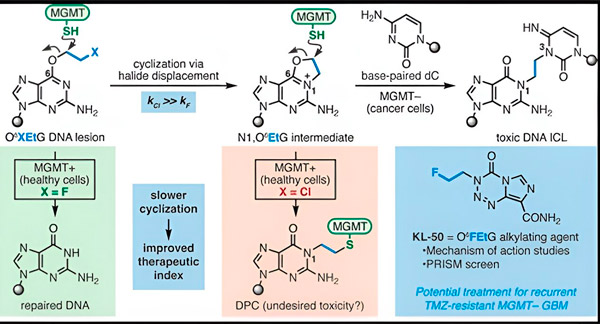
In 2022 ontwikkelden Yale-chemicus Seth Herzon en radiotherapeut dr. Ranjit Bindra een nieuwe strategie om glioblastomen effectiever te behandelen. Ze creëerden een klasse antikankermoleculen, zogenaamde kameleonverbindingen, die gebruikmaken van een defect in een DNA-herstelproteïne dat bekendstaat als O6-methylguanine DNA-methyltransferase (MGMT).
Veel kankercellen, waaronder glioblastomen, missen het MGMT-eiwit. Nieuwe kameleontische verbindingen zijn ontworpen om DNA te beschadigen in tumorcellen zonder MGMT.
Kameleontische verbindingen initiëren DNA-schade door primaire laesies op het DNA te plaatsen die na verloop van tijd evolueren tot zeer toxische secundaire laesies, bekend als interstrand-crosslinks. MGMT beschermt het DNA van gezond weefsel door primaire laesies te herstellen voordat ze kunnen evolueren tot dodelijke interstrand-crosslinks.
Voor hun nieuwe onderzoek concentreerden co-auteurs Herzon en Bindra zich op hun belangrijkste kameleon, KL-50.
"We hebben een combinatie van synthetische chemie en moleculair biologische studies gebruikt om de moleculaire basis van onze eerdere observaties te verhelderen, evenals de chemische kinetiek die de unieke selectiviteit van deze verbindingen bepaalt", aldus Herzon, Milton Harris hoogleraar Chemie aan Yale. "We tonen aan dat KL-50 uniek is doordat het alleen DNA-crosslinks vormt in tumoren met een defect DNA-herstel. Het spaart gezond weefsel."
Bron: Journal of the American Chemical Society (2024). DOI: 10.1021/jacs.3c06483
Dat is een significant verschil, benadrukken de onderzoekers. Een aantal andere antikankermiddelen zijn ontworpen om interstrengs-crosslinks te veroorzaken, maar ze zijn niet selectief voor tumorcellen, wat hun bruikbaarheid beperkt.
Het geheim van het succes van KL-50 schuilt in de timing, merkten de onderzoekers op. KL-50 vormt interstreng-crosslinks langzamer dan andere crosslinkers. Deze vertraging geeft gezonde cellen voldoende tijd om MGMT te gebruiken om de vorming van crosslinks te voorkomen.
"Dit unieke profiel suggereert dat het potentieel heeft voor de behandeling van medicijnresistent glioblastoom, een gebied waar in de kliniek een grote onvervulde behoefte aan is", aldus Bindra, Harvey and Kate Cushing hoogleraar therapeutische radiologie aan de Yale School of Medicine. Bindra is tevens wetenschappelijk directeur van het Chenevert Family Brain Tumor Center in het Smilo Hospital.
Herzon en Bindra stellen dat hun onderzoek het belang benadrukt van het in acht nemen van de snelheid van chemische DNA-modificatie en biochemische DNA-reparatie. Ze geloven dat ze deze strategie kunnen gebruiken om behandelingen te ontwikkelen voor andere vormen van kanker die specifieke tumorgerelateerde DNA-reparatiedefecten vertonen.
