
Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Sleutelproteïne geïdentificeerd om verlies van botmassa bij osteoporose te voorkomen
Laatst beoordeeld: 02.07.2025
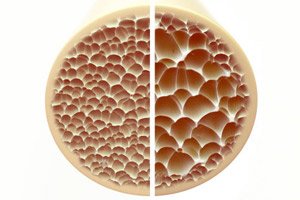
Osteoporose, een aandoening die gekenmerkt wordt door poreuze en broze botten, vormt een aanzienlijke bedreiging voor de gezondheid van het skelet. Botten, als belangrijkste structurele steunpilaar van het menselijk lichaam, bieden essentiële ondersteuning. Wanneer de botmassa afneemt, wordt niet alleen deze ondersteuning verstoord, maar ook de algehele functie, wat leidt tot een verminderde kwaliteit van leven.
Naarmate osteoporose steeds vaker voorkomt bij ouderen, neemt de druk op de zorg voor langdurige zorg toe. Het is daarom noodzakelijk om de mechanismen te begrijpen die bijdragen aan het ontstaan van osteoporose en om effectieve, gerichte behandelingen te ontwikkelen om de langetermijneffecten ervan te minimaliseren.
Osteoblasten en osteoclasten zijn twee celtypen die een sleutelrol spelen in het onderhoud en de remodellering van botweefsel. Osteoblasten zijn botvormende cellen die verantwoordelijk zijn voor de synthese en afzetting van nieuw botweefsel, terwijl osteoclasten botafbrekende cellen zijn die betrokken zijn bij de afbraak en verwijdering van oud of beschadigd botweefsel.
Een toename van het aantal osteoclasten leidt tot botverlies bij aandoeningen zoals osteoporose, reumatoïde artritis (gewrichtsontsteking) en botmetastasen (uitgezaaide kanker). Osteoclasten ontstaan door de differentiatie van macrofagen of monocyten, een soort immuuncellen.
Remming van osteoclastdifferentiatie kan dus dienen als therapeutische strategie om botverlies te voorkomen. De precieze moleculaire mechanismen die het complexe proces van botremodellering reguleren, blijven echter onduidelijk.
In een nieuwe studie hebben professor Tadayoshi Hayata, dhr. Takuto Konno en mw. Hitomi Murachi van de Tokyo University of Science zich samen met collega's verdiept in de moleculaire regulatie van osteoclastdifferentiatie. Stimulatie met de receptor activator van de nucleaire factor kappa B-ligand (RANKL) induceert de differentiatie van macrofagen tot osteoclasten.
Bovendien zijn botmorfogenetische proteïne (BMP) en transformerende groeifactor (TGF)-β signaalroutes betrokken bij de regulatie van RANKL-gemedieerde osteoclastdifferentiatie. In de huidige studie wilden de onderzoekers de rol onderzoeken van Ctdnep1, een fosfatase (een enzym dat fosfaatgroepen verwijdert) waarvan is gerapporteerd dat het BMP- en TGF-β signaalroutes onderdrukt.
Het onderzoek is gepubliceerd in het tijdschrift Biochemical and Biophysical Research Communications.
Professor Hayata stelt: "RANKL fungeert als een 'versneller' voor osteoclastdifferentiatie. Autorijden vereist niet alleen een gaspedaal, maar ook remmen. Hier ontdekten we dat Ctdnep1 als een 'rem' fungeert bij osteoclastdifferentiatie."
De onderzoekers onderzochten eerst de expressie van Ctdnep1 in met RANKL behandelde muizenmacrofagen en onbehandelde controlecellen. Ze observeerden dat de expressie van Ctdnep1 niet veranderde als reactie op RANKL-stimulatie. Het was echter wel in granulaire vorm in het cytoplasma gelokaliseerd in macrofagen en differentieerde tot osteoclasten, wat verschilt van de normale perinucleaire lokalisatie in andere celtypen, wat wijst op de cytoplasmatische functie van Ctdnep1 bij osteoclastdifferentiatie.
Bovendien resulteerde knockdown van Ctdnep1 (downregulatie van genexpressie) in een toename van het aantal osteoclasten dat positief was voor tartraat-resistente zure fosfatase (TRAP), waarbij TRAP een marker is van gedifferentieerde osteoclasten.
Knockout van Ctdnep1 resulteerde in verhoogde expressie van belangrijke differentiatiemarkers, waaronder "Nfatc1", een belangrijke transcriptiefactor die door RANKL wordt geïnduceerd voor osteoclastdifferentiatie. Deze resultaten ondersteunen een "remfunctie" van Ctdnep1, waarbij het de osteoclastdifferentiatie negatief reguleert. Bovendien resulteerde knockout van Ctdnep1 ook in verhoogde calciumfosfaatabsorptie, wat suggereert dat Ctdnep1 een onderdrukkende rol speelt bij botresorptie.
Ten slotte, hoewel Ctdnep1-knockout de BMP- en TGF-β-signalering niet veranderde, vertoonden Ctdnep1-deficiënte cellen verhoogde niveaus van gefosforyleerde (geactiveerde) eiwitten, die producten zijn van de RANKL-signalering. Deze resultaten suggereren dat het remmende effect van Ctdnep1 op osteoclastdifferentiatie mogelijk niet wordt veroorzaakt door BMP- en TGF-β-signalering, maar door downregulatie van de RANKL-signalering en de Nfatc1-eiwitniveaus.
Al met al bieden deze resultaten nieuwe inzichten in het osteoclastdifferentiatieproces en identificeren ze potentiële therapeutische targets die gebruikt kunnen worden om behandelingen te ontwikkelen die botverlies door osteoclastoveractiviteit verminderen. Naast ziekten die gekenmerkt worden door botverlies, is Ctdnep1 ook geïdentificeerd als een veroorzaker van medulloblastoom, een hersentumor bij kinderen. De auteurs zijn optimistisch dat hun onderzoek kan worden uitgebreid naar andere menselijke ziekten dan alleen botmetabolisme.
Professor Hayata concludeert: "Onze resultaten suggereren dat Ctdnep1 nodig is om overmatige osteoclastogenese te voorkomen. Deze resultaten kunnen onze kennis over hoe het fosforylatie-defosforylatienetwerk de osteoclastdifferentiatie reguleert verder vergroten en nieuwe therapeutische strategieën bieden voor de behandeling van botziekten die gepaard gaan met overmatige osteoclastactiviteit."
