
Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Antibacterieel eiwit is een nieuw doelwit voor de behandeling van alvleesklierkanker
Laatst beoordeeld: 02.07.2025
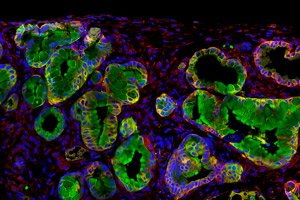
Immunotherapie biedt een nieuwe hoop in de strijd tegen kanker, maar niet alle tumoren reageren op deze behandeling. Alvleesklierkanker is een tumor die niet reageert op de momenteel goedgekeurde medicijnen en daarom dodelijk is voor 9 van de 10 mensen die de diagnose krijgen.
Daarom is het noodzakelijk om nieuwe doelwitten te vinden om resistente cellen aan te vallen, zoals kankerstamcellen. Deze cellen zijn hoofdzakelijk verantwoordelijk voor het ontstaan van tumoren, de vorming van metastasen en resistentie tegen behandelingen.
In een recent onderzoek van de Spaanse Nationale Onderzoeksraad (CSIC), gepubliceerd in het tijdschrift Gut, wordt beschreven hoe alvleesklierkankerstamcellen het antibacteriële eiwit PGLYRP1 gebruiken om het immuunsysteem te omzeilen en zichzelf te beschermen tegen vroegtijdige vernietiging.
Wanneer dit eiwit wordt verwijderd, kunnen de afweermechanismen van het lichaam tumorcellen herkennen en vernietigen. Dit maakt de ontwikkeling van nieuwe immunotherapieën mogelijk die de oorzaak van alvleesklierkanker aanpakken en in de toekomst tot betere behandelingen leiden.
Het onderzoek werd gezamenlijk uitgevoerd door drie wetenschappers: Bruno Sainz, hoofd van de Cancer Stem Cells and Fibroinflammatory Microenvironment Group aan het Biomedical Research Institute of Sols Morreale (IIBM), CSIC-UAM, en de Biomarkers and Personalized Approach to Cancer Treatment (BIOPAC) Group aan het Ramon y Cajal Institute for Health Research (IRYCIS); Christopher Heschen van het Candiolo Cancer Institute (IRCCS) in Italië, en Susana García Silva, wetenschapper bij het Spaanse nationale kankeronderzoekscentrum (CNIO).
De afgelopen tien jaar hebben de drie wetenschappers samengewerkt aan een project waarin ze een populatie alvleesklierkankerstamcellen (CSC's) hebben geïdentificeerd die aanwezig zijn in muismodellen van de ziekte. Deze cellen, de zogenaamde tumorkern, zijn verantwoordelijk voor het terugkeren van de ziekte na chemotherapie of radiotherapie.
Interessant genoeg is alvleesklierkanker ook een van de meest resistente tumoren tegen immunotherapie. De mechanismen waarmee CSC's aan vernietiging door het immuunsysteem ontkomen, zijn tot nu toe echter onduidelijk gebleven.
Dankzij deze samenwerking werd peptide glycan recognition protein 1 (PGLYRP1) geïdentificeerd als een van de redenen waarom CSC's het immuunsysteem ontwijken, met behulp van geavanceerde muismodellen en patiëntmonsters. Dit werk is het eerste dat de rol van dit eiwit, dat overmatig geproduceerd wordt in stamcellen, bij alvleesklierkanker beschrijft. Deze ontdekking legt de basis voor de ontwikkeling van behandelingen hiertegen.
Mogelijke therapie voor de grondoorzaak van alvleesklierkanker
"Wanneer we PGLYRP1 uit tumorcellen verwijderen, zien we dat het immuunsysteem reageert door ze aan te vallen, waardoor de vorming van een primaire tumor en metastatische verspreiding wordt voorkomen", legt Sainz, groepsleider bij IIBM, uit. "We ontwikkelen nu therapieën om dit eiwit te blokkeren of te elimineren, in de hoop deze te kunnen combineren met huidige behandelingen om kankerstamcellen, de wortel van de tumor, effectiever aan te vallen en te elimineren", voegt hij eraan toe.
In de afgelopen vier jaar heeft Juan Carlos Lopez-Gil, de eerste auteur van het artikel, kunnen ontcijferen waarom CSC's dit eiwit produceren bij alvleesklierkanker. Hij zegt: "We zagen dat immuuncellen tumorcellen proberen te vernietigen door tumornecrosefactor (TPF) te produceren, maar PGLYRP1 lijkt sterk op deze factor en interageert met dezelfde receptor, waardoor deze wordt geblokkeerd."
Voor de onderzoeker betekent dit dat “CSC’s zichzelf verdedigen door een onvolledige sleutel (PGLYRP1) te gebruiken om het hangslot (de receptor) te vergrendelen en zo de door tumornecrosefactor veroorzaakte dood (de volledige sleutel) te vermijden.”
Wat de onderzoekers verbaast, is dat een eiwit dat ons immuunsysteem gebruikt om bacteriën te bestrijden, door alvleesklierkanker wordt gebruikt om diezelfde verdediging te dwarsbomen. "De prioriteit voor de toekomst zal liggen bij het begrijpen van de mechanismen waarmee tumorcellen fysiologische processen kapen om de tumoromgeving te 'heropvoeden' en deze ertegen te laten reageren", aldus coauteur Garcia-Silva.
