
Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Bijschildklieren
Medisch expert van het artikel
Laatst beoordeeld: 04.07.2025

In 1879 beschreef de Zweedse wetenschapper S. Sandstrom de bijschildklieren bij mensen en gaf ze een naam. De bijschildklieren zijn vitale organen. Hun functie is het produceren en afscheiden van parathyroïdhormoon (PTH), een van de belangrijkste regulatoren van de calcium- en fosforstofwisseling.
De gepaarde bovenste bijschildklier (glandula parathyroidea superior) en onderste bijschildklier (glandula parathyroidea inferior) zijn ronde of eivormige lichamen die zich aan de achterkant van elk van de schildklierlobben bevinden: één klier bovenaan, de andere onderaan. De lengte van elke klier is 4-8 mm, de breedte is 3-4 mm en de dikte is 2-3 mm. Het aantal van deze klieren is niet constant en kan variëren van 2 tot 7-8; gemiddeld zijn het er vier. De totale massa van de klieren is gemiddeld 1,18 g.
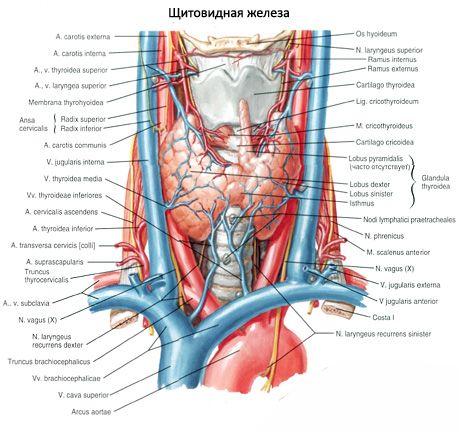
De bijschildklieren verschillen van de schildklier door hun lichtere kleur (bij kinderen zijn ze lichtroze, bij volwassenen geelbruin). Vaak bevinden de bijschildklieren zich op de plaats waar de onderste schildklierslagaders of hun vertakkingen het schildklierweefsel binnendringen. De bijschildklieren worden van het omliggende weefsel gescheiden door hun eigen bindweefselkapsel, van waaruit bindweefsellagen de klieren ingaan. Deze laatste bevatten een groot aantal bloedvaten en verdelen de bijschildklieren in groepen epitheelcellen.
Het parenchym van de klieren wordt gevormd door de hoofdparathyrocyten en acidofiele parathyrocyten, die strengen en clusters vormen, omgeven door dunne bundels bindweefselvezels. Beide celtypen worden beschouwd als verschillende stadia in de ontwikkeling van parathyrocyten. De hoofdparathyrocyten hebben een polyhedrale vorm, een basofiel cytoplasma met een groot aantal ribosomen. Binnen deze cellen worden donkere (actief secreterende) en lichte (minder actieve) cellen onderscheiden. Acidofiele parathyrocyten zijn groot, met duidelijke contouren, en bevatten veel kleine mitochondriën met glycogeendeeltjes.
Het hormoon van de bijschildklieren, parathyroxine (parathyroïdhormoon), is een eiwit en is betrokken bij de regulering van de fosfor-calciumstofwisseling. Parathyroïdhormoon vermindert de calciumuitscheiding in de urine en verhoogt de absorptie ervan in de darm in aanwezigheid van vitamine D. Thyrocalcitonine is een antagonist van parathyroïdhormoon.
Embryogenese van de bijschildklieren
De bijschildklieren ontwikkelen zich uit het epitheel van de gepaarde III en IV kieuwzakken. In de zevende week van de ontwikkeling scheiden de epitheliale rudimenten van de lichamen zich af van de wanden van de kieuwzakken en verplaatsen zich tijdens de groei naar caudale richting. Vervolgens nemen de zich vormende bijschildklieren een vaste plaats voor hen in op de achterste oppervlakken van de rechter- en linkerkwabben van de schildklier.
 [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
[ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
Vaten en zenuwen van de bijschildklieren
De bloedtoevoer naar de bijschildklieren wordt verzorgd door vertakkingen van de bovenste en onderste schildklierslagaders, evenals de slokdarm- en tracheatakken. Veneus bloed stroomt uit via de gelijknamige aderen. De innervatie van de bijschildklieren is vergelijkbaar met die van de schildklier.
Leeftijdsgebonden kenmerken van de bijschildklieren
De totale massa van de bijschildklieren bij een pasgeborene schommelt tussen 6 en 9 mg. Tijdens het eerste levensjaar neemt de totale massa 3-4 keer toe, tegen de leeftijd van 5 jaar verdubbelt deze opnieuw en tegen de leeftijd van 10 jaar verdrievoudigt deze. Na 20 jaar bereikt de totale massa van de vier bijschildklieren 120-140 mg en blijft constant tot op hoge leeftijd. Op alle leeftijden is de massa van de bijschildklieren bij vrouwen iets groter dan bij mannen.
Meestal heeft een persoon twee paar bijschildklieren (boven en onder), gelegen aan de achterkant van de schildklier, buiten het kapsel, nabij de bovenste en onderste polen. Het aantal en de lokalisatie van de bijschildklieren kan echter variëren; soms worden er wel twaalf bijschildklieren aangetroffen. Ze kunnen zich bevinden in het weefsel van de schildklier en de thymus, in het voorste en achterste mediastinum, in het hartzakje, achter de slokdarm, ter hoogte van de vertakking van de halsslagader. De bovenste bijschildklieren hebben de vorm van een afgeplatte eivorm, de onderste zijn bolvormig. Hun afmetingen zijn ongeveer 6x3 tot 4x1,5-3 mm, het totale gewicht is 0,05 tot 0,5 g, de kleur is roodachtig of geelbruin. De bloedtoevoer naar de bijschildklieren vindt voornamelijk plaats via de takken van de arteria thyroidea inferior, de veneuze uitstroom vindt plaats via de aderen van de schildklier, de slokdarm en de luchtpijp. De bijschildklieren worden geïnnerveerd door sympathische vezels van de nervus laryngeus recurrens en de nervus superior, de parasympathische innervatie wordt verzorgd door de nervus vagus. De bijschildklieren zijn bedekt met een dun kapsel van bindweefsel; de septa die zich hiervan uitstrekken, dringen door tot in de klieren. Ze bevatten bloedvaten en zenuwvezels. Het parenchym van de bijschildklieren bestaat uit parathyrocyten, of hoofdcellen, waaronder, afhankelijk van de mate van kleuring, hormonaal actieve licht- of glanscellen, evenals rustende donkere cellen, worden onderscheiden. De hoofdcellen vormen clusters, strengen en clusters, en bij ouderen - follikels met colloïdaal materiaal in de holte. Bij volwassenen verschijnen cellen, voornamelijk gelegen langs de periferie van de bijschildklieren, gekleurd met eosine - eosinofiele of oxyfiele cellen, dit zijn degenererende hoofdcellen. In de bijschildklieren zijn ook overgangsvormen tussen de hoofdcellen en de oxyfiele cellen te vinden.
De eerste successen bij het verhelderen van de synthese, het decoderen van de structuur en het bestuderen van het metabolisme van bijschildklierhormoon werden na 1972 behaald. Bijschildklierhormoon is een enkelketenpolypeptide bestaande uit 84 aminozuren, zonder cysteïne, met een molecuulgewicht van ongeveer 9500 dalton, gevormd in de bijschildklieren uit een bioprecursor - proparathyroïdhormoon (proPTH), dat 6 extra aminozuren aan het NH2 uiteinde heeft. ProPTH wordt gesynthetiseerd in de hoofdcellen van de bijschildklieren (in hun granulair endoplasmatisch reticulum) en wordt tijdens het proces van proteolytische splitsing in het Golgi-apparaat omgezet in bijschildklierhormoon. De biologische activiteit ervan is aanzienlijk lager dan de activiteit van PTH. Blijkbaar is proPTH afwezig in het bloed van gezonde mensen, maar onder pathologische omstandigheden (met adenoom van de bijschildklieren) kan het samen met PTH in het bloed worden afgescheiden. Onlangs is een voorloper van proPTH, preproPTH, ontdekt die 25 extra aminozuren aan de NH2-terminus bevat. PreproPTH bevat dus 115 aminozuren, proPTH - 90 en PTH - 84.
De structuur van runder- en varkensparathyroïdhormoon is inmiddels volledig vastgesteld. Menselijk parathyroïdhormoon is geïsoleerd uit bijschildklieradenomen, maar de structuur ervan is slechts gedeeltelijk ontcijferd. Er zijn verschillen in de structuur van parathyroïdhormoon, maar dierlijke en menselijke parathyroïdhormonen vertonen kruisimmunoreactiviteit. Het polypeptide, bestaande uit de eerste 34 aminozuren, behoudt vrijwel de biologische activiteit van het natuurlijke hormoon. Dit stelt ons in staat om aan te nemen dat bijna 1% van het molecuul aan het carboxyluiteinde niet direct verband houdt met de belangrijkste effecten van parathyroïdhormoon. Fragment 1-29 van parathyroïdhormoon vertoont ook een zekere biologische en immunologische activiteit. Biologisch inactieve fragmenten 53-84 vertonen ook een immunologisch effect, d.w.z. deze eigenschappen van parathyroïdhormoon worden door ten minste twee delen van het molecuul vertoond.
Het bijschildklierhormoon dat in het bloed circuleert, is heterogeen en verschilt van het lichaamseigen hormoon dat door de bijschildklieren wordt afgescheiden. Er worden ten minste drie verschillende typen bijschildklierhormoon in het bloed onderscheiden: intact bijschildklierhormoon met een molecuulgewicht van 9500 dalton; biologisch inactieve stoffen uit het carboxyldeel van het bijschildklierhormoonmolecuul met een molecuulgewicht van 7000-7500 dalton; en biologisch actieve stoffen met een molecuulgewicht van ongeveer 4000 dalton.
Zelfs kleinere fragmenten werden gevonden in veneus bloed, wat aangeeft dat ze in de periferie werden gevormd. De belangrijkste organen waar parathyroïdhormoonfragmenten werden gevormd, waren de lever en de nieren. Fragmentatie van parathyroïdhormoon in deze organen was verhoogd bij leverpathologie en chronisch nierfalen (CRF). Onder deze omstandigheden bleven parathyroïdhormoonfragmenten significant langer in de bloedbaan dan bij gezonde personen. De lever absorbeerde voornamelijk intact parathyroïdhormoon, maar verwijderde noch carboxyl-terminale noch amino-terminale parathyroïdhormoonfragmenten uit het bloed. De nieren speelden een hoofdrol in het metabolisme van parathyroïdhormoon. Ze waren goed voor bijna 60% van de metabole klaring van carboxyl-terminaal immunoreactief hormoon en 45% van het amino-terminale fragment van parathyroïdhormoon. Het belangrijkste gebied van metabolisme van het actieve amino-terminale fragment van parathyroïdhormoon was bot.
Er werd een pulserende secretie van bijschildklierhormoon waargenomen, het meest intens 's nachts. Drie tot vier uur na het begin van de nachtrust is het gehalte ervan in het bloed 2,5 tot 3 keer hoger dan het gemiddelde overdag.
De belangrijkste functie van bijschildklierhormoon is het handhaven van de calciumhomeostase. Tegelijkertijd is serumcalcium (totaal en vooral geïoniseerd) de belangrijkste regulator van de bijschildklierhormoonsecretie (een verlaging van de calciumspiegel stimuleert de bijschildklierhormoonsecretie, terwijl een verhoging deze onderdrukt). De regulatie vindt dus plaats volgens het feedbackprincipe. Bij hypocalciëmie neemt de omzetting van proPTH in bijschildklierhormoon toe. Het magnesiumgehalte in het bloed speelt ook een belangrijke rol bij de afgifte van bijschildklierhormoon (een verhoogd niveau stimuleert, terwijl een verlaagd niveau de bijschildklierhormoonsecretie onderdrukt). De belangrijkste doelwitten van bijschildklierhormoon zijn de nieren en botten, maar het effect van bijschildklierhormoon op de calciumopname in de darm, koolhydraattolerantie, serumlipidenniveaus, de rol ervan bij het ontstaan van impotentie, jeuk, enz. is bekend.
Om de werking van bijschildklierhormoon op botten te karakteriseren, is het noodzakelijk om kort informatie te geven over de structuur van botweefsel en de kenmerken van de fysiologische afbraak en hermodellering ervan.
Het is bekend dat het grootste deel van calcium in het lichaam (tot wel 99%) zich in botweefsel bevindt. Omdat het in botweefsel wordt aangetroffen in de vorm van fosfor-calciumverbindingen, bevindt zich een percentage van het totale fosforgehalte ook in botten. Hun weefsel, ondanks zijn ogenschijnlijk statische aard, wordt voortdurend vernieuwd, is actief gevasculariseerd en heeft uitstekende mechanische eigenschappen. Bot is een dynamische "opslagplaats" van fosfor, magnesium en andere verbindingen die nodig zijn voor het handhaven van de homeostase in de mineraalstofwisseling. De structuur omvat dichte minerale componenten die nauw verwant zijn aan de organische matrix, die bestaat uit 90-95% collageen, kleine hoeveelheden mucopolysacchariden en niet-collageenproteïnen. Het minerale deel van het bot bestaat uit hydroxyapatiet - de empirische formule is Ca10(PO4)6(OH)2 - en amorf calciumfosfaat.
Bot wordt gevormd door osteoblasten die afkomstig zijn van ongedifferentieerde mesenchymcellen. Dit zijn mononucleaire cellen die betrokken zijn bij de synthese van componenten van de organische botmatrix. Ze bevinden zich in een monolaag op het botoppervlak en staan in nauw contact met osteoïd. Osteoblasten zijn verantwoordelijk voor de afzetting van osteoïd en de daaropvolgende mineralisatie. Het product van hun vitale activiteit is alkalische fosfatase, waarvan de hoeveelheid in het bloed een indirecte indicator is van hun activiteit. Omringd door gemineraliseerd osteoïd, veranderen sommige osteoblasten in osteocyten - mononucleaire cellen, waarvan het cytoplasma kanalen vormt die verbonden zijn met de kanalen van naburige osteocyten. Ze nemen niet deel aan botremodellering, maar zijn betrokken bij het proces van perilacunaire destructie, wat belangrijk is voor de snelle regulatie van de calciumspiegels in het bloedserum. Botresorptie wordt uitgevoerd door osteoclasten - gigantische polynucleaire cellen, blijkbaar gevormd door de fusie van mononucleaire macrofagen. Er wordt ook aangenomen dat de voorlopers van osteoclasten hematopoëtische stamcellen van het beenmerg kunnen zijn. Ze zijn mobiel en vormen een laag in contact met het bot, gelegen in gebieden met de grootste resorptie. Door de afgifte van proteolytische enzymen en zure fosfatase veroorzaken osteoclasten collageenafbraak, hydroxyapatietvernietiging en de verwijdering van mineralen uit de matrix. Nieuw gevormd, slecht gemineraliseerd botweefsel (osteoïd) is resistent tegen osteoclastische resorptie. De functies van osteoblasten en osteoclasten zijn onafhankelijk, maar gecoördineerd met elkaar, wat leidt tot normale skeletremodellering. De groei van botlengte hangt af van endochondrale ossificatie, de groei in breedte en dikte van periostale ossificatie. Klinische studies met 47 Ca hebben aangetoond dat tot 18% van het totale calciumgehalte in het skelet jaarlijks wordt vernieuwd. Bij botbeschadiging (fracturen, infectieuze processen) wordt het veranderde bot geresorbeerd en wordt nieuw bot gevormd.
Celcomplexen die betrokken zijn bij het lokale proces van botafbraak en -vorming worden basic multicellular remodeling units (BMU's) genoemd. Ze reguleren de lokale concentratie van calcium, fosfor en andere ionen, de synthese van organische componenten van bot, met name collageen, en de organisatie en mineralisatie ervan.
Het belangrijkste effect van parathyroïdhormoon in de botten van het skelet is het versterken van de resorptieprocessen, wat zowel de minerale als organische componenten van de botstructuur beïnvloedt. Parathyroïdhormoon bevordert de groei van osteoclasten en hun activiteit, wat gepaard gaat met een versterkt osteolytisch effect en een toename van de botresorptie. In dit geval lossen hydroxyapatietkristallen op en komen calcium en fosfor vrij in het bloed. Dit proces is het belangrijkste mechanisme voor het verhogen van de calciumspiegel in het bloed. Het bestaat uit drie componenten: mobilisatie van calcium uit het perilacunaraire bot (diepe osteocyten); proliferatie van osteoprogeneratorcellen tot osteoclasten; het handhaven van een constante calciumspiegel in het bloed door regulering van de calciumafgifte uit het bot (oppervlakkige osteocyten).
Zo verhoogt parathyroïdhormoon aanvankelijk de activiteit van osteocyten en osteoclasten, wat de osteolyse bevordert, wat leidt tot een stijging van het calciumgehalte in het bloed en een verhoogde uitscheiding van calcium en oxyproline in de urine. Dit is het eerste, kwalitatieve en snelle effect van parathyroïdhormoon. Het tweede effect van parathyroïdhormoon op botten is kwantitatief. Het gaat gepaard met een toename van de hoeveelheid osteoclasten. Bij actieve osteolyse ontstaat een stimulus voor verhoogde proliferatie van osteoblasten, waarbij zowel resorptie als botvorming met een overwicht aan resorptie worden geactiveerd. Bij een teveel aan parathyroïdhormoon ontstaat een negatieve botbalans. Dit gaat gepaard met een overmatige uitscheiding van oxyproline - een product van collageenafbraak - en siaalzuren die deel uitmaken van de structuur van mucopolysacchariden. Parathyroïdhormoon activeert cyclisch adenosinemonofosfaat (cAMP). Een verhoogde uitscheiding van cAMP in de urine na toediening van parathyroïdhormoon kan dienen als een indicator voor de gevoeligheid van weefsels voor dit hormoon.
Het belangrijkste effect van parathyroïdhormoon op de nieren is het vermogen om de fosforresorptie te verminderen, wat leidt tot verhoogde fosfaturie. Het reductiemechanisme in verschillende delen van het nefron is verschillend: in het proximale deel is dit effect van parathyroïdhormoon te wijten aan verhoogde permeabiliteit en treedt het op met deelname van cAMP, terwijl het in het distale deel niet afhankelijk is van cAMP. Het fosfaturische effect van parathyroïdhormoon verandert bij vitamine D-deficiëntie, metabole acidose en een verlaagd fosforgehalte. Parathyroïdhormonen verhogen de totale tubulaire reabsorptie van calcium licht. Tegelijkertijd verlagen ze deze in de proximale delen en verhogen ze deze in de distale delen. Dit laatste is van cruciaal belang - parathyroïdhormoon vermindert de calciumklaring. Parathyroïdhormoon vermindert de tubulaire reabsorptie van natrium en het bicarbonaat ervan, wat de ontwikkeling van acidose bij hyperparathyreoïdie kan verklaren. Het verhoogt de vorming van 1,25-dioxycholecalciferol 1,25(OH 2 ) D 3 in de nieren - de actieve vorm van vitamine D 3. Deze verbinding verhoogt de calciumheropname in de dunne darm door de activiteit van een specifiek calciumbindend eiwit (CaBP) in de wand te stimuleren.
De normale concentratie parathyroïdhormoon bedraagt gemiddeld 0,15-0,6 ng/ml. Deze concentratie varieert afhankelijk van leeftijd en geslacht. De gemiddelde concentratie parathyroïdhormoon in het bloed van personen van 20-29 jaar is (0,245 ± 0,017) ng/ml, bij 80-89 jaar (0,545 ± 0,048) ng/ml; de concentratie parathyroïdhormoon bij vrouwen van 70 jaar is (0,728 ± 0,051) ng/ml en bij mannen van dezelfde leeftijd (0,466 ± 0,40) ng/ml. De concentratie parathyroïdhormoon neemt dus toe met de leeftijd, maar bij vrouwen in sterkere mate.
Voor de differentiële diagnose van hypercalciëmie moeten in principe meerdere, verschillende tests worden gebruikt.
Wij presenteren de door ons ontwikkelde klinische en pathogenetische classificatie, gebaseerd op de classificatie van OV Nikolaev en VN Tarkaeva (1974).
Klinische en pathogenetische classificatie van ziekten die verband houden met een verminderde secretie van bijschildklierhormoon en de gevoeligheid daarvoor
Primaire hyperparathyreoïdie
- Volgens pathogenese:
- hyperfunctionerende adenomen;
- hyperplasie van de OGD;
- hyperfunctionerend bijschildkliercarcinoom;
- multipele endocriene neoplasie type I met hyperparathyreoïdie (syndroom van Wermer);
- multipele endocriene neoplasie type II met hyperparathyreoïdie (Sipple-syndroom).
- Volgens klinische kenmerken:
- botvorm:
- osteoporotisch,
- fibrocystische osteïtis,
- "Paginatoïde";
- visceropathische vorm:
- met overwegend schade aan de nieren, het maag-darmkanaal en het neuropsychiatrische gebied;
- gemengde vorm.
- botvorm:
- Stroomafwaarts:
- pittig;
- chronisch.
Secundaire hyperparathyreoïdie (secundaire hyperfunctie en hyperplasie van de bijschildklieren met langdurige hypocalciëmie en hyperfosfatemie)
- Nierpathologie:
- chronisch nierfalen;
- tubulopathie (type Albright-Fanconi);
- nierrachitis.
- Intestinale pathologie:
- malabsorptiesyndroom.
- Botpathologie:
- seniele osteomalacie;
- kraamvrouw;
- idiopathisch;
- Ziekte van Paget.
- Vitamine D-tekort:
- nierziekte;
- lever;
- erfelijke enzymtekorten.
- Kwaadaardige ziekten: myeloom.
Tertiaire hyperparathyreoïdie
- Autonoom functionerende adenomen van de bijschildklieren, die zich ontwikkelen tegen de achtergrond van langdurige secundaire hyperparathyreoïdie.
Pseudohyperparathyreoïdie
- Productie van bijschildklierhormoon door tumoren van niet-bijschildklieroorsprong.
Hormonaal inactieve cysten en tumoren van de bijschildklieren
- Cyste.
- Hormonaal inactieve tumoren of carcinomen.
Hypoparathyreoïdie
- Aangeboren onderontwikkeling of afwezigheid van de bijschildklieren.
- Idiopathische, auto-immuun oorsprong.
- Postoperatief, ontwikkeld in verband met de verwijdering van de bijschildklieren.
- Postoperatief vanwege verminderde bloedtoevoer en innervatie.
- Stralingsschade, van buitenaf en van binnenuit (uitwendige bestraling, behandeling van schildklieraandoeningen met radioactief jodium).
- Schade aan de bijschildklieren door een bloeding of een infarct.
- Infectieuze letsels.
Pseudohypoparathyreoïdie
- Type I - ongevoeligheid van de doelorganen voor bijschildklierhormoon, afhankelijk van adenylaatcyclase;
- Type II - ongevoeligheid van de doelorganen voor bijschildklierhormoon, onafhankelijk van adenylaatcyclase, mogelijk van auto-immuunoorsprong.
Pseudopseudohypoparathyreoïdie
De aanwezigheid van somatische tekenen van pseudohypoparathyreoïdie bij gezonde verwanten in families van patiënten met pseudohypoparathyreoïdie zonder karakteristieke biochemische stoornissen en zonder tetanie.
 [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
Использованная литература

