
Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Geneesmiddelen die trombose voorkomen en de bloedreologie verbeteren
Medisch expert van het artikel
Laatst beoordeeld: 07.07.2025
Om de vorming van meerdere microtromboses tijdens een shock te voorkomen en deze te vernietigen, kunnen verschillende farmacologische benaderingen worden gebruikt die gebruikmaken van medicijnen die de vorming van tromboses voorkomen en de bloedreologie verbeteren:
- eliminatie van systemische hemodynamische en microcirculatiestoornissen met behulp van vasoactieve en inotrope middelen;
- maatregelen om de bloedreologie te verbeteren door middel van rationele infusietherapie en geneesmiddelen die de elasticiteit van de rode bloedcelmembranen herstellen (trental of pentoxifylline);
- preventie van bloedplaatjesaggregatie en de vorming van initiële “witte” trombi in kleine arteriële vaten met daaropvolgende initiatie van de stollingscascade;
- remming van trombusvorming na activering van de systemische stollingscascade;
- activering van de fibrinolyse met als doel het oplossen van nieuwgevormde bloedstolsels (fibrinolysine, streptokinase, streptodecase, urokinase, enz.) of, omgekeerd, remming van de fibrinolyse wanneer deze gegeneraliseerd is bij sommige patiënten met traumatische shock en sepsis (aminocapronzuur, amben, contrical, enz.).
De meeste van de genoemde benaderingen zijn traditioneel, goed ontwikkeld in de praktijk van de behandeling van shock, hebben hun eigen hemorheologische indicaties en worden gespecificeerd in de relevante hoofdstukken. Daarom is het in deze paragraaf raadzaam om stil te staan bij de algemene aanpak van het voorkomen van trombusvorming bij shock met behulp van farmacologische middelen die de profase van de bloedstolling beïnvloeden. Het is dit niveau van preventie van stollingscomplicaties – het optreden, de vorming en de groei van "witte arteriële trombi" – dat de meeste aandacht van onderzoekers trekt.
Verschillende en vaak multidirectionele stoornissen in de bloedstolling met verslechtering van de reologie zijn kenmerkend voor verschillende soorten shock. De meest karakteristieke vorm van septische, endotoxine-, brandwonden-, traumatische en hemorragische shock is de vorming van meerdere microtrombi in de kleinste bloedvaten, veroorzaakt door stoornissen in de systemische hemodynamiek, vasospasmen en microcirculatiestoornissen, bloedverdikking, sludge, verminderde elasticiteit van de erytrocytenmembranen, evenals talrijke algemene en lokale factoren (autocoïden) die lokale veranderingen in de stollingshemostase en de inclusie van de profase van de bloedstolling initiëren.
In een schematische (verkorte) vorm worden de initiële fase van hemocoagulatie en het mechanisme van de lokale hemocoagulatiehomeostase als volgt weergegeven.
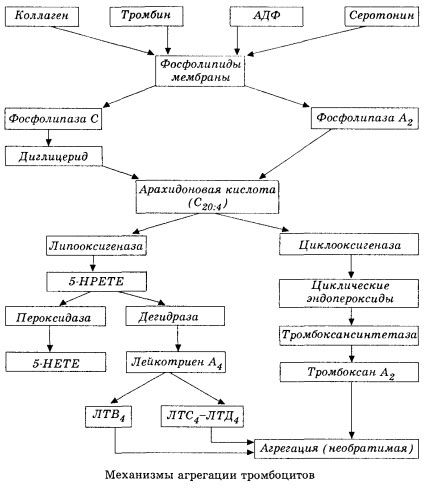
Het begint met de activering van membraanfosfolipase A2 als gevolg van een combinatie van schadelijke factoren (directe membraanschade, hypoxie, lipideperoxidatie, de impact van endogene chemische factoren, enz.). Als gevolg van de afbraak van membraanfosfolipiden komen niet-veresterde langketenvetzuren vrij, waarvan arachidonzuur als uitgangssubstraat het belangrijkste is. De omzetting ervan (arachidonzuurcascade) vindt plaats via de lipoxygenase (synthese van leukotriënen) en cyclooxygenase (synthese van prostaglandinen, tromboxanen, prostacycline).
De resulterende leukotriënen (B4, C4, E4, D4, enz.) – stoffen met een extreem hoge biologische activiteit, waaronder de langzaam reagerende stof van anafylaxie – zijn van groot belang bij het initiëren van lokale vasculaire, ontstekings- en immuunreacties, waaronder auto-immuunprocessen. Leukotriënen veroorzaken microcirculatiestoornissen, verhoogde bloedstolling, afgifte van autolytische lysosomale enzymen en de afgifte in het bloed van een factor die de contractiliteit van het myocard en bronchiale spasmen remt.
Leukotriënen hebben vanwege hun vermogen om samentrekking van glad spierweefsel te veroorzaken een groot effect op de systemische hemodynamiek, de kransslagaders en de hartspier. Ze hebben een sterk kransslagadervernauwend en negatief inotroop effect, wat gepaard gaat met een afname van het hartminuutvolume en een belangrijke rol speelt bij de ontwikkeling van hypotensie.
Een verminderd hartminuutvolume en een hypotensieve reactie op leukotriënen gaan gepaard met verzwakking van de hartspier en beperking van de veneuze terugstroom naar het hart. Van groot belang bij het beperken van de veneuze terugstroom is het vermogen van leukotriënen om de permeabiliteit van de vaatwand te vergroten en plasma-extravasatie te veroorzaken. Leukotriënen worden beschouwd als belangrijk in de pathogenese van een myocardinfarct.
Bij anafylactische en septische (endotoxine) shock lijkt hun rol nog sterker te zijn, zoals blijkt uit het vermogen van leukotriënen om zich tijdens allergische reacties in significante hoeveelheden in plasma te accumuleren en veranderingen in de systemische bloedstroom te veroorzaken die kenmerkend zijn voor anafylactische shock, evenals de beschermende effecten van leukotrieenreceptorblokkers en lipoxygenaseremmers. De ontwikkeling van selectieve leukotrieenreceptorblokkers is momenteel vrij intensief en vormt een veelbelovende wetenschappelijke richting. Op dit gebied zijn al enige successen geboekt en is de effectiviteit van dergelijke blokkers bij myocardischemie, endotoxine- en hemorragische shock experimenteel bevestigd. Het zal echter waarschijnlijk nog enkele jaren duren voordat deze richting klinisch wordt geïmplementeerd.
Als trombocyten en plasmastollingsfactoren in veneuze vaten in gelijke mate bijdragen aan de vorming van trombocyten, dan zijn trombocyten in arteriën de belangrijkste initiators van dit proces. Ze bevatten ADP, Ca2+, serotonine, fosfolipiden, enzymen voor de synthese van prostaglandine en tromboxaan, trombosthenine (net als spieractomyosine zorgt voor het contractievermogen van deze cellen), trombogene groeifactor van epitheel- en spiercellen van de vaatwand en een aantal andere stoffen. De humorale regulatie van de functies van trombocyten wordt uitgevoerd via gespecialiseerde receptoren op hun membranen (alfa-2- en bèta-2-adrenoreceptoren, receptoren voor histamine en serotonine, acetylcholine, tromboxaan, adenosine en een aantal andere). Een bijzondere eigenschap van trombocyten is hun hoge affiniteit voor collageen en andere subendotheliale elementen van de vaatwand, voor niet-bevochtigende en negatief geladen oppervlakken. Deze eigenschap geeft trombocyten het uitzonderlijke vermogen om zich te hechten aan een deel van een bloedvat met beschadigd endotheel, dat ruimschoots de kans heeft om beschadigd te raken tijdens een shock. In dit geval verspreiden de trombocyten zich en laten ze pseudopodia los, die zich aan elkaar en aan de bloedvatwand kunnen hechten. De membraanpermeabiliteit neemt toe en ADP, serotonine, tromboxaan en enkele stollingsfactoren die aan het oppervlak van de trombocyt zijn geadsorbeerd, komen vrij. Deze stoffen interageren met de corresponderende receptoren op het membraan en veroorzaken, met medewerking van calciumionen, aggregatie (aanvankelijk reversibel). Het proces wordt zelfvoorzienend, wat wordt gefaciliteerd door humorale regulerende factoren; andere factoren kunnen het proces juist stoppen en zelfs omkeren, wat leidt tot desaggregatie.
Met de overheersing van trombusvormende invloeden en omstandigheden worden de adhesie- en reversibele aggregatiefasen vervangen door de derde fase - irreversibele aggregatie, die wordt uitgevoerd met de deelname van trombosthenine en leidt tot vernauwing van het stolsel; de reactie van versterking van het aggregant en vernauwing treedt ook op met de deelname van Ca +, ATP en leidt tot de vorming van een witte trombus.
De cyclo-oxygenaseroute van de omzetting van arachidonzuur in bloedplaatjes, vasculaire endotheelcellen en andere weefsels zorgt voor lokale (de halfwaardetijd van metabolieten is zeer kort) stollingshomeostase, aangezien tijdens dit metabolisme krachtige pro- en anti-aggregerende stoffen worden gevormd. De belangrijkste factor die de bloedplaatjesaggregatie in de cyclo-oxygenaseketen van reacties activeert, is tromboxaan A2, en de niet minder krachtige antagonist ervan is prostacycline, geproduceerd door endotheelcellen en, in mindere mate, prostaglandinen van de E- en G-serie. Tot slot wordt de bloedplaatjesaggregatie sterk beïnvloed door aanvullende lokale en systemische humorale factoren.
Bloedplaatjesaggregatieactivatoren en -remmers
Initiatoren en activatoren van bloedplaatjesaggregatie |
Bloedplaatjesaggregatieremmers |
Collageen |
- |
ADP |
Adenosine en zijn stabilisatoren |
Norepinefrine (via alfa2-receptoren) |
Alfa-adrenerge blokkerende middelen |
Serotonine |
Antiserotonine middelen |
Histamine |
Antihistaminica |
Trombine |
Heparine |
Ca2+ |
Ca2+-antagonisten |
CGMP - zijn inductoren (acetylcholine?) en stabilisatoren |
CAM - de inductoren (via bèta-adrenerge receptoren) en stabilisatoren (fosfodiësteraseremmers) |
Arachidonzuur |
Dextranen, albumine |
Tromboxaan A2 |
Prostacycline I2 |
Farmacologische interventies in de beginfase van trombusvorming bij shock en acute ischemische processen in het hart en de hersenen suggereren de volgende mogelijkheid:
- remming van de initiële reacties (totaal en gedeeltelijk) van de arachidonzuurcascade;
- remming van een bepaalde reactie van de tromboxaansynthese;
- blokkade van receptoren voor leukotriënen en tromboxanen in bloedplaatjes, glad spierweefsel en andere cellen;
- het gebruik van stoffen die de bloedplaatjesaggregatie moduleren, dat wil zeggen op andere manieren de reactie van de bloedplaatjes op de invloed van initiërende factoren (collageen, tromboxaan A2, leukotriënen, enz.) verzwakken.
De implementatie van de genoemde methoden voor het corrigeren van stoornissen in de reologische eigenschappen van bloed biedt de oplossing voor de belangrijkste tactische taak: het beschermen van receptoren voor aggregatie en adhesie van bloedplaatjes tegen de werking van activatoren of het onderdrukken van intracellulaire synthesemechanismen van deze receptoren. Remming van de initiële reacties van de arachidonzuurcascade kan worden bereikt door bescherming van bloedplaatjesreceptoren die reageren op polymeeractivatoren, met behulp van laagmoleculaire dextranen, waarvan de moleculen concurreren met fibrine, collageen, geaggregeerd immunoglobuline (IgE) en componenten van het complementsysteem.
Door de receptoren op het bloedplaatjesmembraan te maskeren en te concurreren met grote, verspreide eiwitten op het oppervlak van rode bloedcellen, verdringen laagmoleculaire dextranen deze en vernietigen ze de bruggen tussen cellen. Dit komt doordat dextranen, die het vasculaire endotheel en het oppervlak van bloedcelelementen omhullen, hun negatieve lading verhogen en zo de antiaggregatie-eigenschappen versterken.
Dextranen
Dextranen met een laag moleculair gewicht verminderen de collageen- en ADP-geïnduceerde bloedplaatjesaggregatie, evenals het activerende effect van trombine op bloedplaatjes, remmen de groei van de initiële witte bloedplaatjesthrombus, verbeteren de bloedstroom, verminderen de postoperatieve stijging van het plasmafibrinogeengehalte en veranderen de structuur en stabiliteit van fibrine.
Intraveneuze infusies van dextranen bij trauma en shock verminderen niet alleen de bloedplaatjesaggregatie en -adhesie, maar mobiliseren ook endogene heparine, waardoor de vorming van een los en moeilijk terug te trekken bloedstolsel wordt bevorderd, dat gemakkelijk door fibrinolytica wordt afgebroken. De antitrombineactiviteit van laagmoleculaire dextranen hangt samen met hun specifieke effect op de structuur en functie van bloedstollingsfactor VIII. Factor VIII (antihemofiel globuline), een groot molecuul met een complexe structuur en functie, is betrokken bij de bloedplaatjesaggregatie en de stabiliteit van het resulterende stolsel. Dextranen interfereren met de werking van factor VIII, waardoor de bloedplaatjesaggregatie wordt vertraagd en de stabiliteit van het stolsel afneemt.
Laagmoleculaire dextranen zijn geen echte anticoagulantia en hun corrigerende werking bij hemorheologische aandoeningen hangt vooral samen met hemodilutie, aanvulling van het circulerende plasmavolume en verbetering van de bloedstroom in de microcirculatie.
Het vermogen van dextranen om de bloedstroom te verbeteren bij hemodynamische aandoeningen (shock, bloedverlies) is te danken aan een complex van factoren. Het optreden van een hoge, tijdelijke concentratie van het polymeer in het bloed leidt niet alleen tot "directe hemodilutie", maar creëert ook de voorwaarden voor de vloeistofstroom vanuit de interstitiële ruimte naar de bloedbaan en de daaropvolgende balans van het osmotische effect van dextran. Als gevolg van hemodilutie neemt de viscositeit van het bloed af, neemt de veneuze instroom naar het hart toe en neemt het hartminuutvolume toe. Naast deze effecten vormen dextranen complexen met fibrinogeen en hebben ze een antilipemisch effect.
De antiaggregerende werking en hemodynamische effecten van laagmoleculaire dextranen helpen de bloedviscositeit te verlagen, wat vooral belangrijk is bij lage schuifsnelheden. Desaggregatie van bloedcellen verbetert de systemische bloedstroom en microcirculatie, met name in het veneuze deel, waar de snelheidsgradiënten het laagst zijn. Het gebruik van laagmoleculaire dextranoplossingen bij verschillende vormen van shock, tijdens chirurgische behandeling van verwondingen en de gevolgen daarvan, en vervolgens in de postoperatieve periode helpt hypercoagulatie te voorkomen en de kans op trombotische processen en embolie te verkleinen.
Er dient echter rekening mee te worden gehouden dat infusies met dextranoplossingen in sommige gevallen gepaard gaan met anafylactische en allergische reacties (gevaarlijk in geval van sensibilisatie en anafylactische shock). Dit komt doordat dextranen, met hun hoge molecuulgewicht en vele zijketens, als antigeen kunnen fungeren. Om de individuele gevoeligheid te bepalen, wordt daarom aanbevolen om intraveneus maximaal 20 ml van een laagmoleculaire dextranoplossing als hapteen (15% oplossing, moleculair gewicht 1000) toe te dienen en infusies met een plasmavervanger uit te voeren vóór de anesthesie.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Trombineremmers
Farmacologische bescherming van bloedplaatjesreceptoren die interageren met bloedplaatjesactivatoren kan ook worden bereikt met middelen die concurreren met niet-polymere bloedplaatjesactivatoren of deze remmen. Dergelijke middelen omvatten trombineremmers (heparine en hirudine, een aantal synthetische remmers, adrenaline-antagonisten), alfa-receptorblokkers (fentolamine, dihydro-ergotamine), ADP-antagonisten (dipyridamol, adenosine en zijn structurele analogen, fosfocreatine), en serotonine-antagonisten (methysergide). Slechts enkele van de genoemde middelen worden daadwerkelijk gebruikt voor de preventie en behandeling van shock van verschillende oorsprong.
Bescherming van intracellulaire mechanismen van de synthese van proteïnereceptoren die reageren met activatoren van bloedplaatjesaggregatie en -adhesie, en remming van tromboxaansyntheseprocessen zijn mogelijk met geneesmiddelen uit verschillende groepen:
- inductoren en stabilisatoren van cATP, prostacycline en prostaglandine PgE2;
- fosfolipase- en fosfodiësteraseremmers.
De intensieve ontwikkeling van speciale plaatjesaggregatieremmers is relatief recent begonnen en heeft nog niet tot betrouwbare resultaten geleid. Momenteel worden in de klinische praktijk, naast dextranoplossingen, ook plaatjesaggregatieremmers zoals acetylsalicylzuur, indomethacine, dipyradamol, sulfinpyrazon (persantin), prostacycline (eicoprostenon) en heparine veelvuldig gebruikt om de vorming van witte bloedplaatjes-trombi te voorkomen.
Niet-steroïde ontstekingsremmende geneesmiddelen
Het is vastgesteld dat de farmacologische effecten van niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) – acetylsalicylzuur en indomethacine – voortkomen uit hun effect op het metabolisme van eicosanoïden (tromboxanen en prostaglandinen). Vrijwel alle geneesmiddelen in deze groep remmen het enzymcomplex prostaglandinesynthetase, waardoor ze hun specifieke en anti-aggregerende effecten uitoefenen.
Acetylsalicylzuur wordt na orale toediening zeer snel geabsorbeerd. Het hydrolyseproduct, salicylzuur, remt de cyclo-oxygenase van bloedplaatjes, wat de omzetting van arachidonzuur in prostaglandine O2 en uiteindelijk tromboxaan A2 verstoort. Acetylsalicylzuur remt de aggregatie die wordt geïnduceerd door collageen, ADP, adrenaline en serotonine. Hoewel de GG05-waarde 15 minuten bedraagt, houdt het antiaggregerende effect enkele dagen aan, wat blijkbaar wordt verklaard door de irreversibele remming van prostaglandinesynthesereacties en de onderdrukking van de bloedplaatjesaggregatiefunctie gedurende de gehele levensduur (6-10 dagen). Naast de remming van de cyclo-oxygenase van bloedplaatjes remt acetylsalicylzuur in hoge doses de cyclo-oxygenase van de vaatwand en remt het, gelijktijdig met de onderdrukking van de tromboxaan A2-synthese, de prostacyclinesynthese in endotheelcellen. Daarom moet acetylsalicylzuur worden voorgeschreven als antiaggregant in kleine doses (3000-5000 mg/dag), die voornamelijk de bloedplaatjesaggregatie remmen.
Aangezien acetylsalicylzuur de cyclo-oxygenase van bloedplaatjes gedurende meerdere dagen blokkeert en de cyclo-oxygenase van endotheelcellen niet langer dan één dag, is het rationeel om het medicijn niet dagelijks, maar om de 3-4 dagen voor te schrijven. De optimale dosis acetylsalicylzuur voor elke patiënt moet individueel worden bepaald, aangezien patiënten verschillend reageren op de plaatjesaggregatieremmende werking van het medicijn. Bij reactieve patiënten remt acetylsalicylzuur in een dosis van 0,5 g de plaatjesaggregatie met 40-50%, bij hyperreactieve patiënten met 80-90%, en bij reactieve patiënten is de afwezigheid van een plaatjesaggregatieremmend effect kenmerkend bij inname van dezelfde dosis van het medicijn.
Selectieve tromboxaansynthetaseremmers zijn imidazol en zijn analogen, die cyclo-oxygenase niet blokkeren. Dipyridamol, dat in de klinische praktijk wordt gebruikt als coronaire dilatator bij de behandeling van chronische ischemische hartziekte, remt net als imidazol selectief tromboxaansynthetase, waardoor de synthese van tromboxaan A2 wordt voorkomen. Het geneesmiddel en zijn analogen zouden ook de fosfodiësterase van bloedplaatjes remmen, waardoor de cAMP-concentratie in bloedplaatjes stijgt. Dipyridamol remt daarnaast de activiteit van adenosinedeaminase en de opname van adenosine door bloedplaatjes, en blokkeert de absorptie van serotonine door bloedplaatjes en de aggregatie ervan, geïnduceerd door adrenaline en collageen. Er zijn meldingen van een zwakke plaatjesremmende werking van het geneesmiddel en het vermogen ervan om in lage doses de plaatjesaggregatie te bevorderen. Het meest betrouwbare plaatjesremmende effect kan worden bereikt met een combinatie van dipyridamol en acetylsalicylzuur.
Heparine
Van de antitrombotische middelen is heparine een van de meest effectieve regulatoren van de bloedaggregatietoestand, vooral bij vroegtijdig gebruik. Heparine heeft een hoge negatieve lading en kan interageren met zowel grote als kleine ionen en moleculen (enzymen, hormonen, biogene aminen, plasma-eiwitten, enz.), waardoor het biologische werkingsspectrum vrij breed is. Het geneesmiddel heeft antitrombine-, antitromboplastine- en antiprotrombine-effecten, voorkomt de omzetting van fibrinogeen in fibrine, onderdrukt het terugtrekken van stolsels en bevordert de fibrinolyse.
Het mechanisme van de anticoagulerende werking van heparine is vrij complex. Het is inmiddels vastgesteld dat de anticoagulerende effecten van heparine samenhangen met de versterking van de werking van antitrombine III en de verbetering van het vermogen van het heparine-antitrombine III-complex om de meeste serineproteasen van het bloedstollingssysteem snel te inactiveren. Bij de antitrombotische werking van heparine is het vermogen om een hoog elektronegatief potentieel van de vasculaire intima te verhogen en te behouden, en zo bloedplaatjesadhesie en de vorming van microtrombi te voorkomen, van groot belang. Heparine onderdrukt het meest actief trombusvorming in venen en voorkomt zowel lokale trombusvorming als gedissemineerde intravasculaire stolling.
Prostacycline en zijn stabiele analogen
Van de plaatjesaggregatieremmers zijn prostacycline en de stabiele analogen daarvan de krachtigste aggregatieremmers. Het plaatjesaggregatieremmende effect van prostacycline is te danken aan de stimulatie van adenylaatcyclase en, als gevolg daarvan, een toename van de cAMP-concentratie in bloedplaatjes, een afname van het tromboxaangehalte, een afname van het tromboxaangehalte A2 en blokkering van de receptoren. Prostacycline is instabiel en hydrolyseert snel tot inactieve producten. Daarom wordt het intraveneus toegediend via een infuus met een snelheid van 2 tot 20 ng/kg per minuut gedurende 30-60 minuten, tot maximaal 6 keer per dag.
Prostacycline heeft, naast een sterk aggregatieremmend effect, een krachtig vaatverwijdend en bronchusverwijdend effect. Het medicijn verwijdt de bloedvaten van de hersenen, het hart, de nieren, de skeletspieren en de mesenteriale vaten. Onder invloed van prostacycline neemt de coronaire bloeddoorstroming toe, neemt de energievoorziening van de hartspier toe en neemt de zuurstofbehoefte af. Ondanks de instabiliteit in het lichaam kunnen klinisch gunstige effecten enkele weken en zelfs maanden aanhouden. Het werkingsmechanisme van deze langdurige werking is nog niet duidelijk.
Prostacycline is een geneesmiddel met een lage toxiciteit, maar het gebruik ervan kan bijwerkingen veroorzaken: blozen, hoofdpijn, een verlaagde bloeddruk, buikpijn en anorexia. Naast prostacycline zijn de synthetische stabiele analogen (iloprost, enz.) veelbelovende remmers van bloedplaatjesaggregatie.
Geneesmiddelen die de bloedviscositeit verbeteren
Verstoringen in de reologische eigenschappen van bloed tijdens trauma en shock worden niet alleen veroorzaakt door veranderingen in de functionele activiteit van bloedplaatjes, maar ook door een toename van de bloedviscositeit. De structurele viscositeit van bloed, als complex dynamisch verspreid systeem, wordt grotendeels bepaald door de viscositeit van plasma en het vermogen van erytrocyten om te vervormen. Plasmaviscositeit hangt voornamelijk af van de concentratie eiwitten in het bloed. Eiwitten met een laag molecuulgewicht, zoals albumine, hebben weinig effect op de plasmaviscositeit, terwijl eiwitten met een groot molecuulgewicht (fibrinogeen, alfa- en gammaglobulinen, andere macromoleculen) deze aanzienlijk verhogen.
Bij lage schuifsnelheden leidt de adsorptie van fibrinogeen en globulinen aan het oppervlak van erytrocyten tot de vorming van bruggen tussen aangrenzende cellen en de vorming van aggregaten vanuit erytrocyten. De snelheid waarmee aggregaten worden gevormd, is een complex biofysisch proces en hangt niet alleen af van de grootte van de schuifkracht, maar ook van de elektrokinetische eigenschappen van erytrocyten, de concentratie, massa en sorptiecapaciteit van de macromoleculen-aggregatoren, en van de vorm en plasticiteit van erytrocyten.
Het behouden van de vorm en mechanische eigenschappen van het erytrocytenmembraan vereist een aanzienlijk energieverbruik. Aangenomen wordt dat de energie die erytrocyten tijdens glycolyse produceren, wordt besteed aan fosforylering van spectrine, wat resulteert in veranderingen in de secundaire structuur van het eiwit en interactie met aangrenzende componenten van het binnenmembraan. De interactie tussen de structurele eiwitten van het membraan, spectrine en actine, speelt een belangrijke rol bij de vorming van de mechanische eigenschappen van het erytrocytenmembraan, door een constant oppervlak en een constante dikte van de erytrocyt te behouden, ongeacht de vervorming.
Bij systemische hemodynamische en orgaandoorbloedingsstoornissen leidt de toename van de stijfheid van de erytrocytenmembranen en de vorming van erytrocytenaggregaten tot een afname van de passagesnelheid van erytrocyten door de haarvaten, waardoor de gastransportfunctie van het bloed verstoord raakt. Daarom moet de correctie van stoornissen in de reologische eigenschappen van bloed in shock, naast het voorkomen van erytrocytenaggregatie, ook de normalisatie van de plasma- en bloedviscositeit, aggregatie en vervorming van erytrocyten omvatten.
Naast laagmoleculaire dextranen zijn albumineoplossingen een van de effectieve middelen om de stabiliteit van bloedsuspensies te verhogen. In de late shockperiode treedt algemene aggregatie van erytrocyten op tegen een achtergrond van een daling van de albumineconcentratie in het bloedplasma en een stijging van de concentratie van fibrinogeen en globulinen, met name de alfa2-fractie, lipoproteïnen en lipiden. Onder deze omstandigheden worden de reologische effecten van albumine veroorzaakt door twee belangrijke factoren: hemodilutie en normalisatie van de verhouding tussen micro- en macroglobulinen in plasma. Tegelijkertijd bindt albumine vrije zuren, waarvan de aggregatie tijdens trauma en shock de aggregatie van cellulaire structuren in het bloed en intravasculaire stolling stimuleert en vetembolie kan veroorzaken.
Antishockmaatregelen gericht op het aanvullen van het circulerende bloedvolume en het elimineren van weefselhypoxie en metabole acidose, dragen bij aan de normalisatie van de elasticiteit van erytrocytenmembranen, aangezien hypoxie en acidose de vervormbaarheid van erytrocyten aanzienlijk verminderen. Een verhoogde stijfheid van erytrocytenmembranen bij shock houdt waarschijnlijk verband met een remming van de ATP-synthese in erytrocyten. Een verlaging van de ATP-concentratie draagt op zijn beurt bij aan een verhoging van de Ca2+-concentratie in erytrocyten, wat, door binding aan membraaneiwitten, de stijfheid van het membraan vergroot.
Eén van de farmacologische geneesmiddelen die het ATP-gehalte in rode bloedcellen en de elasticiteit van rode bloedcelmembranen verhoogt, is Trental (pentoxifylline), dat in de klinische praktijk wordt gebruikt voor de behandeling van ischemische aandoeningen.
Naast het verminderen van de stijfheid van rode bloedcelmembranen, veroorzaakt Trental vaatverwijding, verbetert het de zuurstofvoorziening van weefsels, remt het de fosfodiësterase-activiteit in weefsels, verhoogt het de cAMP-concentratie en remt het de bloedplaatjesaggregatie.
Onder de farmacologische middelen die de elasticiteit van het rode bloedcelmembraan handhaven, vallen met name Ca2+-antagonisten op. Deze beperken de ionenstroom naar de rode bloedcel (flunarizine, nifedipine, enz.).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Aandacht!
Om de perceptie van informatie te vereenvoudigen, werd deze instructie voor het gebruik van het medicijn "Geneesmiddelen die trombose voorkomen en de bloedreologie verbeteren" vertaald en gepresenteerd in een speciale vorm op basis van de officiële instructies voor medisch gebruik van het medicijn. Lees vóór gebruik de annotatie die rechtstreeks naar de medicatie is gekomen.
Beschrijving verstrekt voor informatieve doeleinden en is geen handleiding voor zelfgenezing. De behoefte aan dit medicijn, het doel van het behandelingsregime, de methoden en dosering van het medicijn wordt uitsluitend bepaald door de behandelende arts. Zelfmedicatie is gevaarlijk voor je gezondheid.

