
Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Gliomen van de hersenen
Medisch expert van het artikel
Laatst beoordeeld: 29.06.2025
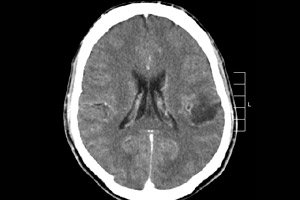
Van de vele tumorprocessen van het centrale zenuwstelsel wordt hersenglioom het vaakst gediagnosticeerd - deze term is een verzamelnaam, het neoplasma combineert alle diffuse oligodendrogliale en astrocytaire foci, astrocytoom, astroblastoom enzovoort. Zo'n tumor kan een verschillende mate van maligniteit hebben, is gevormd uit gliale structuren - cellen gelokaliseerd rond neuronen. De belangrijkste locaties van gliomen zijn de hersenhelften, de wanden van de hersenventrikels en het chiasma - het gebied waar de oogzenuwvezels gedeeltelijk elkaar kruisen. Uiterlijk is de tumor een nodulair element met een roze of roodachtige tint, een ronde of spoelvormige configuratie met onduidelijke grenzen. [ 1 ]
Epidemiologie
In ongeveer 5% van de gevallen worden gliomen geassocieerd met erfelijke aandoeningen, met name neurofibromatose en andere syndromen met een dominante overerving. Deskundigen wijzen erop dat de absolute meerderheid van de hersengliomen sporadisch ontstaat, dat wil zeggen zonder duidelijke oorzaak.
In totaal vormen primaire neoplasmata van het centrale zenuwstelsel ongeveer 2% van alle tumoren, oftewel iets meer dan 21 gevallen per honderdduizend inwoners. Gliomen komen in 35-36% van de gevallen voor, en meer dan 15% daarvan zijn glioblastomen.
Volgens sommige gegevens treft gliomen vaker mannen dan vrouwen. De tumor komt vooral vaak voor bij mensen ouder dan 50 jaar.
De wereldwijde incidentie van gliomen bij ouderen is de afgelopen decennia aanzienlijk toegenomen. De oorzaken voor dit fenomeen zijn nog niet vastgesteld.
Volgens de definitie van de Wereldgezondheidsorganisatie zijn er drie hoofdvarianten van gliale tumoren geïdentificeerd, die verschillen in hun histologische kenmerken. Dit zijn oligodendrogliomen, astrocytomen en gecombineerde oligoastrocytomen. De incidentie van elk subtype van laag-maligne pathologie is niet betrouwbaar vastgesteld. Sommige studies wijzen op een toename van de incidentie van oligodendrogliomen van 5% tot 30% en een afname van de incidentie van astrocytomen.
Gliatumoren kunnen hersenweefsel infiltreren, en de overgrote meerderheid van de laaggradige haarden wordt binnen enkele jaren kwaadaardig. [ 2 ]
Oorzaken hersengliomen
Hersengliomen vormen een hele groep tumorprocessen die zich, met als gemeenschappelijk kenmerk, ontwikkelen vanuit gliale structuren van het centrale zenuwstelsel (CZS) in het hersenweefsel. Dergelijke tumoren worden onderverdeeld in twee histopathologische varianten: hoogmaligne en laagmaligne gliomen.
De bron van de groei zijn neurogliacellen (astrocyten, oligodendrocyten). Zij vormen de structurele basis en de levensvatbaarheid van hersenneuronen.
Gliatumorprocessen verschillen sterk in structuur, mutatieveranderingen in genen, agressiviteit, klinische kenmerken, diagnostische kenmerken, respons op behandeling en prognose van patiënten. Embryonale en ependymale neoplasmata van het centrale zenuwstelsel – met name medulloblastomen en ependymomen – verschillen in hun histologische structuur, maar zijn vergelijkbaar qua behandeling.
Glia-elementen werden voor het eerst eind 19e eeuw geclassificeerd als een aparte structurele categorie van het zenuwstelsel.
Neurogliaweefsel bestaat uit cellen met ondersteunende functies: trofisch, ondersteunend, beschermend en secretoir. Neuronen en gliocyten bestaan samen, vormen samen het zenuwstelsel en zijn van groot belang voor de algemene processen van de vitale activiteit van het organisme.
Gliocyten worden grofweg onderverdeeld in verschillende hoofdvormen: astrocyten, oligodendrocyten, ependymale cellen en microglia.
Wetenschappers kunnen tot op heden geen antwoord geven op de vraag naar de betrouwbare oorzaken van neurogliale tumorvorming. Vermoedelijk spelen radioactieve effecten, infectieziekten en vergiftiging (vooral chemische en beroepsmatige) een zekere negatieve rol. Ook erfelijke factoren spelen een rol.
Hersengliomen ontstaan door abnormale neurogliocyten met een genetisch defect dat leidt tot abnormale groei en functionaliteit – dergelijke structuren worden 'onvolgroeid' genoemd. Onvolledige cellen bevinden zich vaker in één gebied, waar de tumor zich vormt.
Simpel gezegd is gliale vorming het resultaat van chaotische en sporadische groei van gemodificeerde neurogliacellen. Het proces kan zich ontwikkelen vanuit ependymocyten, oligodendrocyten en astrocyten (astrocytoom, inclusief reuzencellen en anaplastische cellen). [ 3 ]
Risicofactoren
Ondanks het feit dat deskundigen de oorzaken van de vorming van gliale oncopathologieën niet nauwkeurig kunnen karakteriseren, kan hun optreden in sommige gevallen worden voorkomen door de belangrijkste risicofactoren te elimineren:
- Blootstelling aan ioniserende straling heeft een kankerverwekkende werking en kan leiden tot de ontwikkeling van leukemie en de vorming van kankerprocessen met een dichte structuur, ook bij jonge mensen. Frequente en onredelijke radiologische medische ingrepen en ultraviolette straling (waaronder zonnebanken) behoren ook tot de potentiële kankerverwekkende effecten en kunnen tumoren veroorzaken in verschillende organen, waaronder de hersenen.
- Beroepsgerelateerde schadelijke effecten en vergiftigingen hebben vaak een causaal verband met de ontwikkeling van kankergezwellen. De productie van rubber en glas, pesticiden en brandstoffen, metalen en textiel, verf en laboratoriumreagentia wordt als bijzonder gevaarlijk beschouwd. Werknemers in de lucht- en ruimtevaart, de kolen- en metaalindustrie, chemische en bijproductverwerkende bedrijven, bouwmaterialen en elektroden, brandstoffen en smeermiddelen, kunststoffen en monomeren lopen risico.
- Lucht-, water- en bodemverontreiniging zijn verantwoordelijk voor tot wel 4% van alle kankerziekten wereldwijd. Kankerverwekkende stoffen, die in grote hoeveelheden in het milieu aanwezig zijn, komen in het lichaam terecht via ingeademde lucht, drinkwater en voedsel. Wonen in ecologisch onveilige gebieden - in de buurt van grote industriële installaties en drukke verkeersknooppunten - wordt als bijzonder gevaarlijk beschouwd.
- Infectieziekten – met name virale infecties – kunnen ook gunstige omstandigheden creëren voor de ontwikkeling van tumoren. Het is belangrijk om hier rekening mee te houden en je vooraf te laten vaccineren, evenals om infectieuze en parasitaire ziekten te voorkomen.
- Tabaks- en alcoholvergiftiging worden gezien als risicofactoren voor veel soorten kanker, niet alleen voor hersengliomen.
- Onvoldoende lichaamsbeweging, overgewicht, slechte voeding, stofwisselingsstoornissen, hoofdletsel, vaatpathologieën zijn extra stressfactoren die intracellulaire stoornissen kunnen veroorzaken.
- Op oudere leeftijd ontstaan de meeste tumoren in het lichaam. Mensen ouder dan 55 jaar moeten daarom extra goed op hun gezondheid letten.
De belangrijkste en meest significante risicofactor voor het ontwikkelen van gliomen blijft echter erfelijke aanleg.
Pathogenese
Tot op heden hebben experts een aantal aannames over de ontwikkeling van hersengliomen. Elke theorie heeft zijn eigen onderbouwing, maar het enige juiste en betrouwbare pathogene mechanisme hebben wetenschappers nog niet geïdentificeerd. In de meeste gevallen hebben we het over de volgende factoren bij de ontwikkeling van neoplasmata:
Embryogenesefalen, waarbij de aanmaak van organen verstoord raakt en er 'verkeerde' celstructuren ontstaan;
- Blootstelling aan ioniserende straling, potentiële kankerverwekkende stoffen in de vorm van chemische stoffen, levensmiddelenadditieven, enz.;
- Hoofdtrauma;
- Genstoornissen die van generatie op generatie worden doorgegeven ("familiaire" gliomen);
- Immuunstoornissen, neuro-infecties.
De meeste gliomen hebben een diffuse groei, met penetratie in het omliggende gezonde hersenweefsel. Afhankelijk van de mate van maligniteit kan de tumor zich enkele jaren ontwikkelen zonder enige manifestatie. Bij een agressief beloop nemen de symptomatologie snel toe gedurende enkele maanden.
Tumorvorming wordt deels veroorzaakt door dysembryogenetische veranderingen.
De hersenstam kan op verschillende niveaus worden aangetast: diffuus hersenstamglioom verschilt op zijn beurt zowel anatomisch-morfologisch als klinisch. Sommige van dergelijke neoplasmata – met name het glioom van de quadriplegieplaat – kunnen relatief goedaardig zijn, zonder tekenen van progressie. Een ponsglioom daarentegen wordt gekenmerkt door een specifieke maligniteit, agressiviteit en slechte prognose.
Diffuse laesies van hersenstructuren, waarbij meer dan drie anatomische zones van de grote hemisferen betrokken zijn bij het pathologische proces, met mogelijke periventriculaire divergentie en passage door het corpus gliomatose. [ 4 ]
Is hersenglioom erfelijk?
Een bewezen risico op hersenglioomvorming is erfelijk – dat wil zeggen de aanwezigheid van vergelijkbare of andere intracerebrale tumoren bij directe voorouders of in dezelfde generatie. Blootstelling aan radioactieve stoffen en regelmatig of langdurig contact met potentieel kankerverwekkende stoffen verergeren de situatie.
Niet alleen gliomen kunnen erfelijk zijn, maar ook ziekten die gepaard gaan met toegenomen tumorgroei zonder dat de lokalisatie ervan wordt genoemd – dit kunnen met name neurofibromatose type 1 en 2, het Li-Fraumeni-syndroom en het Hippel-Lindau-syndroom zijn. Vaak worden in glioomcellen veranderingen in bepaalde genen of chromosomen gedetecteerd.
De belangrijkste pathologieën die gepaard gaan met de ontwikkeling van gliomen bij mensen worden in de tabel samengevat:
Pathologie |
Chromosoom |
Gen |
Verscheidenheid aan neoplasmata |
Li-Fraumeni-syndroom |
17р13 |
TR53 |
Neuroectodermale neoplasmata, astrocytoom. |
Neurofibromatose |
17q11 |
NF1 |
Oogzenuwglioom, pilocytair astrocytoom, neurofibromatose |
Syndroom van Turcotte |
3p21, 7p22 |
HMLH1, HPSM2 |
Astrocytoom |
Tubereuze sclerose (syndroom van Burneville). |
9q34, 16p13 |
TSC1, TSC2 |
Gigantocellulair subependymaal astrocytoom |
Ongeacht de aard van de gliale tumor, of het nu een sporadisch geval is of een erfelijke aandoening, het is een aandoening waarbij een pathologisch veranderd gen tot expressie komt. Afgezien van neoplasmata die ontstaan als gevolg van leereffecten, blijven in andere situaties de oorzaken van genetische afwijkingen onduidelijk.
Symptomen hersengliomen
De kenmerken van focale symptomatologie zijn direct afhankelijk van de lokalisatie van het hersenglioom en zijn het gevolg van allerlei endocriene stoornissen, compressie van zenuwweefsel of lokale destructieve processen.
Als de tumor zich in de pariëtale zone bevindt, worden de symptomen overheerst door toevallen, sensorische stoornissen en gehoorverlies.
Wanneer het glioom zich in het gebied van de dominante hemisfeer bevindt, worden spraakstoornissen, agrafie en agnosie vastgesteld.
Neoplasmata van de temporaalkwab gaan vaak gepaard met convulsieve aanvallen, afasie, een verminderd reukvermogen, verminderd gezichtsvermogen en kortademigheid.
Wanneer de intracraniële druk toeneemt, ontstaat een bijbehorend beeld met beperking van het gezichtsveld, verlamming van de oogspieren en hemiplegie.
Vanwege de specificiteit van het tumorproces gaat een hersenglioom altijd in meer of mindere mate gepaard met neurologische symptomen. In het begin is er een merkbare algemene zwakte, de patiënt wil constant slapen, het werkvermogen is verminderd en het denkvermogen is vertraagd. In dit stadium is het risico groot dat een verkeerde diagnose wordt gesteld en dat daardoor de verkeerde behandeling wordt voorgeschreven. Andere niet-specifieke verschijnselen zijn:
- Vestibulaire stoornissen, waaronder een onzekere gang, verlies van evenwicht (bijvoorbeeld bij het fietsen of traplopen), gevoelloosheid in de ledematen, enz.;
- Geleidelijke verslechtering van het zicht, verdubbeling van het visuele beeld;
- Verslechtering van de gehoorfunctie;
- Onduidelijk spreken;
- Misselijkheid en braken in de vorm van aanvallen, onafhankelijk van eten of drinken;
- Verzwakking van de mimische spieren en andere gezichtsspieren;
- Ongemak bij het slikken;
- Regelmatige hoofdpijn (vaak in de ochtenduren).
Het klinische beeld breidt zich geleidelijk uit en verergert: bij sommige patiënten ontstaat het langzaam, bij anderen abrupt, letterlijk "voor hun ogen", binnen enkele weken. In het laatste geval hebben we het over een agressief, snel ontwikkelend hersenglioom.
Eerste tekenen
Hersengliomen in de vroege stadia van ontwikkeling vertonen geen uitgesproken symptomatologie. De eerste manifestaties worden vaak verward met tekenen van andere, minder gevaarlijke pathologieën.
Over het algemeen is het klinische beeld van een glioom divers en wordt het bepaald door de locatie en grootte van de pathologische focus. Naarmate de neoplasma groeit, ontwikkelen zich algemene cerebrale symptomen en nemen deze toe:
- Aanhoudende en regelmatige hoofdpijn die niet reageert op standaardmedicatie (niet-steroïde anti-inflammatoire geneesmiddelen);
- Af en toe misselijkheid, soms zelfs braken;
- Een onaangenaam, zwaar gevoel in de oogbol;
- Epileptische aanvallen.
Cerebrale manifestaties zijn bijzonder intens wanneer de tumor in de ventrikels of het liquorsysteem groeit. De afvoer van hersenvocht is verstoord, de intracraniële druk neemt toe en er ontstaat hydrocefalie. Het proces beïnvloedt een bepaald deel van de hersenen, wat de ontwikkeling van de bijbehorende kliniek beïnvloedt:
- Er zijn problemen met de visuele functie;
- Spraakstoornis;
- Er ontstaan evenwichtsstoornissen (duizeligheid, verminderde coördinatie van bewegingen);
- Parese, verlamming van de armen, benen;
- Het geheugen en de concentratie zijn aangetast;
- Denkprocessen zijn verstoord;
- Er ontstaan steeds meer gedragsstoornissen.
In het beginstadium zijn de symptomen vrijwel afwezig, of zo onbeduidend dat ze niet opvallen. Om deze reden adviseren deskundigen dringend om regelmatig preventief onderzoek en controles te laten uitvoeren. Hoe eerder het tumorproces wordt ontdekt, hoe groter de kans op genezing en overleving. [ 5 ]
Glioom van de hersenen bij een kind
Van de vele hersentumoren die bij kinderen worden aangetroffen, varieert het percentage gliomen van 15 tot 25%. Kinderen kunnen de ziekte krijgen in hun vroege tienerjaren en begin twintig, hoewel het zeer zeldzaam is dat baby's jonger dan 3 jaar de ziekte krijgen.
De pathologie begint tegen de achtergrond van mutaties in gliacellen. Tot op heden is er geen antwoord op de vraag waarom deze mutatie optreedt.
Het enige dat we met zekerheid weten, is dat bepaalde erfelijke ziekten die gepaard gaan met een verhoogd risico op tumorgroei, ook de kans op het ontwikkelen van een hersenglioom vergroten.
Bovendien hebben wetenschappers ontdekt dat gliacellen divergentie kunnen vertonen in individuele genen of chromosomen. Door deze aandoening treedt een mutatiemechanisme in werking, dat niet erfelijk is. Het is mogelijk dat dit al in een van de vroegste ontwikkelingsstadia gebeurt.
Het is een bewezen feit dat de aanwezigheid van acute leukemie of retinoblastoom in de voorgeschiedenis van het kind, of bestraling van de hersenen om een andere reden, de kans op het ontstaan van gliomen (na een bepaalde tijd) aanzienlijk vergroot.
De symptomatologie bij kinderen hangt af van de mate van maligniteit en de lokalisatie van de pathologische focus. Er wordt onderscheid gemaakt tussen specifieke en niet-specifieke symptomen:
- Niet-specifieke symptomen zijn niet "gebonden" aan het gebied waar het glioom zich bevindt. Veelvoorkomende verschijnselen zijn hoofdpijn, duizeligheid, slechte eetlust, braken zonder verband met de voedselinname, gewichtsverlies (om onbekende redenen), een constant gevoel van vermoeidheid, verminderde schoolprestaties, concentratieproblemen en gedragsstoornissen. Deze symptomen worden veroorzaakt door compressie van intracraniële structuren, wat verklaard kan worden als een directe druk van de groeiende massa, en een verstoring van de circulatie van hersenvocht. Er bestaat een risico op hersenhydrocèle.
- De specifieke symptomatologie hangt af van de directe locatie van de gliale pathologische focus. Zo gaat een cerebellumtumor bij kinderen meestal gepaard met een verstoorde gang en evenwicht. De laesie van de grote hersenen manifesteert zich door convulsieve aanvallen en tumorgroei in het ruggenmerg - verlamming van de spieren. Het kan voorkomen dat het gezichtsvermogen van de baby sterk verslechtert, het bewustzijn verstoord raakt, de slaap verstoord raakt of er een ander ontwikkelingsprobleem optreedt.
In de regel openbaart een kwaadaardig glioom zich bij kinderen binnen enkele weken of maanden na de geboorte: vaak gekenmerkt door een snelle en ongecontroleerde groei van de tumor.
Kinderen met maligne gliale tumoren worden behandeld door artsen in pediatrische klinieken die gespecialiseerd zijn in pediatrische oncologie. Meestal worden chirurgische behandeling, bestraling en chemotherapie toegepast.
De belangrijkste behandelstap is neurochirurgie. Hoe radicaler de ingreep, hoe groter de kans op genezing voor het kind. Maar chirurgisch ingrijpen is niet altijd mogelijk: met name bij het verwijderen van hersenstamgliomen en bij bestraling bij kinderen jonger dan 3 jaar kunnen er problemen ontstaan.
Gliomen van de centrale hersenen (intermediaire en middenhersenen) zijn moeilijk volledig te verwijderen, omdat er een risico bestaat op beschadiging van gezond weefsel. Als volledige resectie van de tumor niet mogelijk is, krijgt de patiënt palliatieve behandeling voorgeschreven.
Kinderen met maligne gliomen worden behandeld volgens gestandaardiseerde protocollen die zijn vastgesteld in streng gecontroleerde klinische studies. De meest voorkomende protocollen zijn als volgt:
- HIT HGG 2007: betreft de behandeling van kinderen in de leeftijd van 3 tot 17 jaar.
- HIT SKK: geschikt voor baby's (tot drie jaar) en vereist geen bestraling.
De overlevingsstatistieken voor gliomen bij kinderen zijn over het algemeen niet erg optimistisch. Het is echter in geen geval mogelijk om vooraf de effectiviteit van de behandeling voor een bepaald kind te voorspellen. Het is belangrijk om alle instructies van de arts nauwgezet op te volgen, wat de kans op herstel aanzienlijk vergroot.
Vormen
Gliomen kunnen laag- en hoogmalign zijn, met intense groei en een neiging tot uitzaaiing. Het is belangrijk om te begrijpen dat een lage maligniteit niet synoniem is met tumorveiligheid. Elke hersentumor creëert extra volume, drukt op hersenstructuren, wat leidt tot verplaatsing en verhoogde intracraniële druk. Als gevolg hiervan kan de patiënt overlijden.
Er zijn twee hoofdtypen maligne astrocytomen: glioblastomen en anaplastische astrocytomen. Deze worden onderverdeeld op basis van moleculaire veranderingen. Secundaire maligne tumoren die zijn ontstaan uit astrocytomen en een lage maligniteitsgraad hebben, worden het vaakst aangetroffen bij jonge patiënten. Maligne gliale tumoren komen aanvankelijk vaker voor bij oudere patiënten.
Afhankelijk van de structurele locatie komen gliomen voor in:
- Supratentoriaal (met lokalisatie boven de kleine hersenen in het gebied van de laterale ventrikels, grote hemisferen);
- Subtentorieel (met lokalisatie onder de kleine hersenen in de achterste schedelgroeve).
Op basis van histologische kenmerken worden de volgende typen gliomen onderscheiden:
- Astrocytisch glioom is het meest voorkomend. Het wordt onderverdeeld in nodulair en diffuus (dit laatste kan gekenmerkt worden door snelle groei en een beroertepatroon).
- Oligodendroglioom - komt voor bij 5% van de patiënten. Het heeft versteende plekken - verkalkte plekken, meestal in de frontale kwab.
- Ependymaal glioom - groeit vanuit de structuren die de wanden van het centrale kanaal van het ruggenmerg en de ventrikels bekleden. Groeit vaak in de dikte van de hersensubstantie, evenals in het lumen van de hersenen.
Gemengde pathologische foci zoals subependymoom, oligoastrocytoom, enz. zijn ook mogelijk.
Alle gliomen worden in de volgende stadia ingedeeld:
- Langzaam groeiende, relatief goedaardige gezwellen zonder duidelijke klinische symptomen.
- Langzaam groeiende 'grens'-gliomen die geleidelijk transformeren naar stadium III en verder.
- Kwaadaardig glioom.
- Kwaadaardig glioom met intense, agressieve groei en verspreiding, met een slechte prognose.
Hoe lager het maligniteitsstadium, hoe kleiner de kans op uitzaaiing en recidief van de verwijderde tumor, en hoe groter de kans op genezing van de patiënt. Het grootste gevaar wordt gevormd door glioblastoma multiforme, een laaggedifferentieerd proces met intensieve groei en ontwikkeling. [ 6 ]
Mogelijke en meest voorkomende varianten van neuroglioom:
- Een glioom met hersenstam- en ponslaesies bevindt zich in het gebied waar de hersenen verbinding maken met het ruggenmerg. Daar bevinden zich belangrijke neurocentra die verantwoordelijk zijn voor de ademhaling, het hart en de motoriek. Bij beschadiging van deze zone is de werking van het evenwichtsorgaan en het spraakapparaat verstoord. Het wordt vaak in de kindertijd ontdekt.
- Visueel glioom tast de neurogliacellen aan die de oogzenuw omringen. De pathologie veroorzaakt visuele beperkingen en exoftalmie. Het komt vaker voor bij kinderen.
- Laagmaligne neurogliomen worden gekenmerkt door een trage groei, vaker gelokaliseerd in de grote hemisferen en de kleine hersenen. Het komt vaker voor bij jonge mensen (adolescenten en jongvolwassenen rond de 20 jaar).
- Glioom van het corpus callosum komt het meest voor bij personen tussen de 40 en 60 jaar oud. Het meest voorkomend is een glioblastoom.
- Chiasmaglioom is gelokaliseerd in de optische overgangszone en gaat daarom gepaard met bijziendheid, gezichtsveldverlies, occlusieve hydrocefalie en neuro-endocriene aandoeningen. Het kan op elke leeftijd voorkomen, maar treft meestal patiënten met neurofibromatose type I.
Complicaties en gevolgen
Gliomen met een lage maligniteit (graad I-II, zeer kwaadaardig - bijvoorbeeld astrocytoom, oligoastrocytoom, oligodendroglioom, pleomorf xanthoastrocytoom, enz.) en een hoge maligniteit (graad III-IV - glioblastoom, anaplastisch oligodendroglioom, oligoastrocytoom en astrocytoom). Gliomen met een graad IV zijn bijzonder kwaadaardig.
Hersenstamglioom heeft een zeer ongunstige prognose, juist omdat de tumor een dergelijk hersengebied aantast, waar de belangrijkste zenuwverbindingen tussen de hersenen en de ledematen geconcentreerd zijn. Zelfs een relatief kleine tumor in dit gebied kan de toestand van de patiënt snel doen verslechteren en verlamming veroorzaken.
Niet minder ongunstige gevolgen doen zich voor wanneer andere hersengebieden worden aangetast. Vaak gaat het om een tumor in de hersenschors, die de patiënt ondanks de behandeling geen kans biedt op een lang leven. Vaak is het alleen mogelijk de dood uit te stellen.
Volgens medische statistieken bedraagt de overlevingskans na vijf jaar vaak slechts 10-20%. Deze cijfers hangen echter grotendeels af van zowel de mate van maligniteit als de exacte lokalisatie en het volume van de uitgevoerde chirurgische ingreep. Na volledige verwijdering van de pathologische focus neemt de overlevingskans aanzienlijk toe (soms tot wel 50%). Het uitblijven van behandeling of de onmogelijkheid daarvan (om de een of andere reden) leidt gegarandeerd tot de dood van de patiënt.
De meeste laag-kwaadaardige gliale tumoren kunnen hersenweefsel infiltreren en binnen enkele jaren kwaadaardig worden.
De kans op terugkeer van het glioom wordt door deskundigen als "zeer waarschijnlijk" ingeschat. Desondanks mag de behandeling niet worden verwaarloosd: het is belangrijk om zo lang mogelijk een goede kwaliteit van leven te garanderen.
Recidiverende gliomen hebben altijd een slechtere prognose dan primaire tumoren. Moderne behandelprotocollen gebaseerd op therapeutische optimalisatiestudies behalen echter vaak voldoende goede resultaten voor patiënten, zelfs met zeer kwaadaardige neoplasmata.
Mogelijke uitkomsten na chemotherapie:
- Vermagering, vermagering, spijsverteringsstoornissen, mondziekten;
- Verhoogde prikkelbaarheid van het centrale zenuwstelsel, asthenie;
- Verslechtering van het gehoor, oorsuizen en oorsuizen;
- Toevallen, depressieve stoornissen;
- Hypertensieve crisis, verandering in het bloedpatroon;
- Nierfalen;
- Allergische processen, haaruitval, het ontstaan van pigmentvlekken op het lichaam.
Na chemotherapie merken patiënten een sterke verzwakking van het immuunsysteem, wat kan leiden tot de ontwikkeling van verschillende infectieziekten.
Diagnostics hersengliomen
Een hersenglioom kan worden vermoed door de volgende tekenen:
- De patiënt heeft gelokaliseerde of gegeneraliseerde epileptische aanvallen, die kenmerkend zijn voor de corticale locatie van het neoplasma en de langzame ontwikkeling ervan. Epileptische aanvallen worden aangetroffen bij 80% van de patiënten met laaggradige gliale tumoren en bij 30% van de patiënten met hooggradige gliomen.
- Verhoogde intracraniale druk is met name kenmerkend voor massa's in de rechter frontale en pariëtale kwabben. Een hoge intracraniale drukstoornis in de bloedsomloop en de liquorcirculatie gaat gepaard met aanhoudende en toenemende hoofdpijn, misselijkheid met braken, visuele stoornissen en slaperigheid. Er is oedeem van de oogzenuw en verlamming van de afleidende zenuw. Een toename van de intracraniale druk tot kritische waarden kan leiden tot coma en overlijden. Een andere oorzaak van een hoge intracraniale druk is hydrocefalie.
- De patiënt heeft een groeiend focaal beeld. Bij supratentoriële formaties zijn de motorische en sensorische sferen verstoord, verergeren hemiopie, afasie en cognitieve stoornissen.
Als de arts de aanwezigheid van een hersentumor vermoedt, is het optimaal om een MRI-scan uit te voeren met of zonder contrastmiddel (gadolinium) om de locatie, grootte en aanvullende kenmerken ervan te bepalen. Als magnetische resonantiebeeldvorming (MRI) niet mogelijk is, wordt computertomografie (CT) uitgevoerd en magnetische resonantiespectroscopie (MRI) gebruikt als differentiatiemethode. Ondanks de informatieve waarde van deze diagnostische methoden, wordt de definitieve diagnose pas gesteld na histologische bevestiging tijdens resectie van de tumorfocus.
Gezien bovenstaande criteria wordt aanbevolen om de diagnose te beginnen met een grondige anamnese, beoordeling van de somato-neurologische status en functionele status. De neurologische status wordt beoordeeld in combinatie met het vaststellen van mogelijke intellectuele en mentale stoornissen.
Aanbevolen laboratoriumtests:
- Een volledig algemeen klinisch bloedonderzoek;
- Een volledig bloedchemiepaneel;
- Urineonderzoek;
- Bloedstollingsonderzoek;
- Analyse van oncologische markers (AFP, bèta-hCG, LDH - relevant bij vermoeden van een laesie van de pijnappelklierzone).
Om de prognostische punten bij patiënten met glioblastoom en anaplastisch astrocytoom te verduidelijken, worden de IDH1|2-1-genmutatie en de MGMT-genmethylering geëvalueerd. Bij patiënten met oligodendroglioom en oligoastrocytoom wordt de 1p|19q-codlelatie bepaald.
Instrumentele diagnostiek bestaat allereerst uit verplichte MRI van de hersenen (soms ook van het ruggenmerg). MRI wordt uitgevoerd in drie projecties met behulp van de standaard T1-2, FLAIR en T1-modi met contrast.
Indien geïndiceerd worden echografie van het vaatnetwerk, functionele magnetische resonantie beeldvorming van de motorische en spraaksecties, evenals angiografie, spectroscopie, MR-tractografie en perfusie verricht.
Aanvullende onderzoeken kunnen zijn:
- Elektro-encefalografie van de hersenen;
- Consultaties bij neurochirurg, oncoloog, radioloog, oogarts, radioloog.
Differentiële diagnose
Differentiële diagnose wordt noodzakelijkerwijs uitgevoerd bij niet-tumorpathologieën - in het bijzonder bij bloedingen veroorzaakt door arterioveneuze of arteriële malformatie, evenals bij pseudotumorale demyeliniserende processen, ontstekingsziekten (toxoplasmose, hersenabces, enz.).
Daarnaast moet er onderscheid worden gemaakt tussen de primaire tumorhaard en metastasen in het centrale zenuwstelsel.
Met moderne MRI-technologie is het mogelijk om diagnostische metingen nauwkeurig genoeg uit te voeren om de oorsprong van de primaire focus in het centrale zenuwstelsel te achterhalen. MRI van de hersenen wordt uitgevoerd met of zonder contrast, in T1- of T2-FLAIR-modus - in drie projecties, of dunne plakjes in axiale projectie (SPGR-modus). Deze diagnostische methoden maken het mogelijk om de locatie, grootte en structurele kenmerken van het neoplasma, de relatie met het vaatnetwerk en nabijgelegen hersengebieden nauwkeurig te bepalen.
Daarnaast kunnen CT (met of zonder contrastmiddel), CT-angiografie (MR-angiografie), MR-tractografie, MR of CT-perfusie worden uitgevoerd als onderdeel van de differentiële diagnose. CT/PET van de hersenen met methionine, choline, tyrosine en andere aminozuren wordt indien geïndiceerd gebruikt.
Behandeling hersengliomen
Specifieke therapie bestaat uit chirurgische, chemotherapeutische en radiotherapeutische maatregelen. Indien mogelijk is een volledige resectie van de tumorfocus vereist, wat snelle symptoomverlichting en histologische bevestiging van de diagnose mogelijk maakt.
Bestraling heeft een positief effect op de levensverwachting van patiënten. Standaard wordt een totale dosis van 58 tot 60 Gy toegediend, verdeeld over individuele bestralingsdoses van 1,8-2 Gy. De tumor wordt lokaal bestraald, waarbij tot 3 cm eromheen wordt ingevangen. Radiotherapie is acceptabeler dan brachytherapie. In sommige gevallen worden radiochirurgische methoden aanbevolen, bestaande uit bestraling met een gammames of lineair gaspedaal, evenals neutronenvangst met boor.
De noodzaak van adjuvante chemotherapie is controversieel. In sommige gevallen konden nitrosoureumpreparaten de levensverwachting van patiënten met maximaal anderhalf jaar verlengen, maar sommige resultaten van dergelijke chemopreparaten waren negatief. Tegenwoordig worden cytotoxische middelen, neoadjuvante therapie (vóór bestraling), combinatietherapie, intra-arteriële chemotherapie of chemotherapie met hoge doseringen en verdere stamceltransplantatie actief gebruikt.
Over het algemeen is voor een succesvolle behandeling van gliomen een alomvattende aanpak van groot belang, waarvan de omvang afhangt van de locatie en de mate van maligniteit van de massa, de grootte ervan en de algemene gezondheidstoestand van de patiënt.
Chirurgische interventie wordt zelden toegepast bij hersenstamgliomen. De belangrijkste contra-indicatie voor een operatie is de lokalisatie van het brandpunt – in de nabijheid van vitale delen. In sommige gevallen is het mogelijk om een glioom van de romp te verwijderen met behulp van microchirurgische methoden, met preoperatieve en postoperatieve chemotherapie. Een dergelijke interventie is zeer complex en vereist speciale kwalificaties van een neurochirurg.
Radiochirurgie, en met name stereotactische chirurgie met blootstelling aan hoge ioniserende doses, is zeer effectief. Het gebruik van een dergelijke techniek in de vroege stadia van de ontwikkeling van een neoplasma maakt het soms mogelijk om een langdurige remissie of zelfs volledige genezing van de patiënt te bereiken.
Bestraling wordt vaak gecombineerd met chemotherapie, wat de effectiviteit van interventies verbetert en de stralingsbelasting vermindert. Bij gliomen zijn niet alle chemopreventieve middelen therapeutisch succesvol, daarom worden ze individueel voorgeschreven en indien nodig aangepast.
Om de pijn te verminderen en de intracraniële druk te verlagen, wordt ongeacht de hoofdbehandeling symptomatische therapie voorgeschreven - met name corticosteroïden, pijnstillers en kalmeringsmiddelen.
Medicijnen
Corticosteroïden hebben een effect op de zwelling en verminderen de ernst van neurologische symptomen gedurende enkele dagen. Vanwege de vele bijwerkingen en de verhoogde kans op nadelige interacties met chemotherapie, worden echter minimaal effectieve doses steroïden gebruikt en moet de behandeling zo snel mogelijk worden stopgezet (bijvoorbeeld na een operatie).
Anticonvulsiva worden systematisch gebruikt als secundaire preventieve maatregel bij patiënten die al epileptische aanvallen hebben gehad. Deze medicijnen kunnen ernstige bijwerkingen veroorzaken en ook een wisselwerking hebben met chemotherapie.
Anticoagulantia zijn vooral relevant in de postoperatieve fase, aangezien de kans op het ontstaan van tromboflebitis bij gliomen vrij hoog is (tot 25%).
Een goed effect wordt verwacht van het gebruik van antidepressiva en anxiolytica. Het gebruik van methylfenidaat 10-30 mg/dag in twee doses maakt het vaak mogelijk om de cognitieve vaardigheden te optimaliseren, de kwaliteit van leven te verbeteren en het werkvermogen te behouden.
Neurologisch falen en tekenen van hersenoedeem (hoofdpijn, bewustzijnsstoornissen) worden verholpen door corticosteroïdmedicijnen, met name prednisolon of dexamethason. |
Het schema en de dosering van corticosteroïden worden individueel gekozen, waarbij de minimaal effectieve dosis wordt aangehouden. Aan het einde van de behandeling worden de medicijnen geleidelijk afgebouwd. |
Corticosteroïden worden samen met maagbeschermende medicijnen ingenomen - protonpompblokkers of H2- histamineblokkers. |
Diuretica (Furosemide, Mannitol) worden voorgeschreven bij ernstige zwellingen en verschuivingen van hersenstructuren, als aanvulling op corticosteroïdmedicijnen. |
Bij convulsieve aanvallen (inclusief anamnese) of epileptiforme verschijnselen op het elektro-encefalogram (ECG) wordt aanvullend anticonvulsieve therapie voorgeschreven. Anticonvulsiva worden niet voorgeschreven voor profylactische doeleinden. |
Patiënten met chemotherapie-indicaties wordt geadviseerd anticonvulsiva te gebruiken die de leverenzymfunctie niet beïnvloeden. Medicijnen van eerste keus: Lamotrigine, Valproïnezuur, Levetiracetam. Niet gebruiken: Carbamazepine, Fenobarbital. |
Hoofdpijn door hersengliomen wordt behandeld met corticosteroïdtherapie. |
Bij sommige hoofdpijnen kunnen niet-steroïde anti-inflammatoire geneesmiddelen of tramadol worden gebruikt. |
Als de patiënt niet-steroïde anti-inflammatoire geneesmiddelen gebruikt, worden deze enkele dagen voor de operatie stopgezet om de kans op bloedingen tijdens de operatie te minimaliseren. |
Bij bepaalde vormen van pijn kunnen narcotische pijnstillers, zoals Fentanyl of Trimeperidine, worden aanbevolen. |
Om longembolie vanaf de derde dag na de operatie te voorkomen, wordt toediening van laagmoleculaire heparines voorgeschreven, met name enoxaparinenatrium of nadroparinecalcium. |
Indien de patiënt een systematische behandeling met anticoagulantia of antiaggreganten ondergaat, wordt hij uiterlijk een week vóór de chirurgische ingreep overgezet op laagmoleculaire heparines. De behandeling wordt vervolgens een dag vóór de operatie stopgezet en 24-48 uur na de operatie hervat. |
Bij een patiënt met een glioom met veneuze trombose van de onderste extremiteiten wordt behandeling met directe anticoagulantia toegepast. De mogelijkheid van plaatsing van een CAVA-filter is niet uitgesloten. |
Chemotherapie voor kwaadaardige gliomen in de hersenen
De basis antitumorchemotherapieregimes voor gliomen zijn:
- Lomustine 100 mg/m² op dag één, Vincristine 1,5 mg/m² op dag één en acht, Procarbazine 70 mg/m² van dag acht tot en met eenentwintigste dag, kuren om de zes weken.
- Lomustine 110 mg/m² om de zes weken.
- Temozolomide 5/23 150 tot 200 mg/m² van dag één tot dag vijf, elke 28 dagen.
- Temozolomide als onderdeel van chemoradiotherapie, 75 mg/m² per dag dat de straling wordt gegeven.
- Temozolomide met cisplatine of carboplatine (80 mg/m²) en temozolomide 150-200 mg/m² op dag 1 tot en met 5, elke 4 weken.
- Temozolomide 7/7 100 mg/m² op dag 1-8 en 15-22 van de kuur, met een herhaling elke vier weken.
- Bevacizumab 5 tot 10 mg/kg op dag één en vijftien, en Irinotecan 200 mg/m² op dag één en vijftien, elke vier weken herhaald.
- Bevacizumab 5 tot 10 mg/kg op dag één, vijftien en negenentwintig, en Lomustine 90 mg/m² op dag één, elke zes weken.
- Bevacizumab 5 tot 10 mg/kg op dag één en vijftien, Lomustine 40 mg op dag één, acht, vijftien en tweeëntwintig, elke zes weken herhaald.
- Bevacizumab 5 tot 10 mg/kg op dag één en vijftien, elke vier weken herhaald.
Cytostatica remmen in veel gevallen succesvol de groei van tumorcellen, maar zijn niet selectief ten opzichte van gezonde weefsels en organen. Daarom hebben experts een aantal contra-indicaties geïdentificeerd waarbij chemotherapie van gliomen onmogelijk is:
- Overmatige individuele gevoeligheid voor chemopreventieve middelen;
- Decompensatie van hart-, nier- en leverfunctie;
- Verminderde hematopoëse in het beenmerg;
- Problemen met de bijnierfunctie.
Chemotherapie wordt met de grootste voorzichtigheid toegepast:
- Patiënten met ernstige hartritmestoornissen;
- Met diabetes;
- Bij acute virusinfecties;
- Voor oudere patiënten;
- Patiënten die lijden aan chronisch alcoholisme (chronische alcoholintoxicatie).
De ernstigste bijwerking van chemopreventieve medicijnen is hun toxiciteit: cytostatica verstoren selectief de functionaliteit van bloedcellen en veranderen hun samenstelling. Als gevolg hiervan neemt de massa van bloedplaatjes en rode bloedcellen af en ontstaat bloedarmoede.
Voordat een arts een chemotherapiekuur voorschrijft, houdt hij altijd rekening met de mate van toxiciteit van de medicijnen en de mogelijke complicaties na gebruik. Chemotherapiekuren worden altijd nauwlettend gevolgd door specialisten en er wordt regelmatig bloed afgenomen.
Mogelijke gevolgen van cytostatische therapie:
- Magerheid, vermagering;
- Moeilijkheden met slikken, droge slijmvliezen, parodontitis, dyspepsie;
- Instabiliteit van het centrale zenuwstelsel, manisch-depressieve stoornissen, aanvalssyndroom, asthenie;
- Verslechtering van de gehoorfunctie;
- Verhoging van de bloeddruk tot aan het ontstaan van een hypertensieve crisis;
- Afname van bloedplaatjes, rode bloedcellen, witte bloedcellen, meerdere bloedingen, inwendige en uitwendige bloedingen;
- Nierfalen;
- Allergische processen;
- Haaruitval, het ontstaan van gebieden met verhoogde pigmentatie.
Na chemotherapie is de kans groter dat patiënten infectieziekten ontwikkelen. Ook spier- en gewrichtspijn komt vaak voor.
Om het risico op nadelige effecten na chemotherapie te verminderen, worden verdere revalidatiemaatregelen voorgeschreven, met als doel het normale bloedbeeld te herstellen, de cardiovasculaire activiteit te stabiliseren en de neurologische toestand te normaliseren. Er moet voldoende psychologische ondersteuning worden geboden.
Chirurgische behandeling
De operatie wordt uitgevoerd om de tumorhaard zoveel mogelijk te verwijderen, wat op zijn beurt de intracraniële druk zou moeten verminderen, de neurologische insufficiëntie zou moeten verminderen en het benodigde biomateriaal voor onderzoek zou moeten opleveren.
- De operatie wordt uitgevoerd op een gespecialiseerde neurochirurgische afdeling of kliniek waarvan de specialisten ervaring hebben met neuro-oncologische ingrepen.
- De chirurg verricht toegang door middel van plastische bottrepanatie in het gebied waar vermoedelijk een glioom is gelokaliseerd.
- Als het neoplasma anatomisch dicht bij motorische gebieden of paden, of in de celkern of langs hersenzenuwen ligt, wordt intraoperatieve neurofysiologische monitoring toegepast.
- Neuronavigatiesystemen, intraoperatieve fluorescentienavigatie met 5-aminolevuleenzuur, zijn wenselijk om de verwijdering van het neoplasma te maximaliseren.
- Na de ingreep wordt op dag 1-2 een controle-CT of MRI (met of zonder contrastinjectie) gemaakt.
Indien chirurgische resectie van het glioom onmogelijk is of in eerste instantie als onwenselijk wordt beschouwd, of indien er een vermoeden bestaat van een lymfoom van het centrale zenuwstelsel, wordt een biopsie (open, stereotactisch, met navigatiemonitoring, enz.) uitgevoerd. |
Patiënten met cerebrale gliomatose worden geverifieerd door middel van stereotactische biopsie, omdat de therapeutische tactieken grotendeels afhankelijk zijn van het histologische beeld. |
In bepaalde situaties - bij oudere patiënten, bij ernstige neurologische aandoeningen, bij lokalisatie van gliomen in de romp en andere vitale delen - wordt de behandeling gepland op basis van de symptomen en beeldinformatie na een algemeen medisch consult. |
Bij patiënten met piloïd astrocytoom en nodulaire vormen van hersenstamneoplasmata en exofytische uitsteeksels wordt een resectie of open biopsie aanbevolen. |
Patiënten met een diffuus ponsglioom en andere diffuse neoplasmata van de romp worden behandeld met radiotherapie en antitumormedicatie. Verificatie is in deze gevallen niet nodig. |
Patiënten met een quadriplegisch plaatglioom ondergaan systematische magnetische resonantie en klinische monitoring na verwijdering van een cerebrale hydrocèle. Indien het neoplasma tekenen van groei vertoont, wordt het verwijderd met verdere bestraling. |
Wanneer een gedeeltelijke resectie of biopsie van een laaggradig maligne glioom wordt uitgevoerd, worden patiënten met twee of meer risicofactoren noodzakelijkerwijs behandeld met radiotherapie en/of chemotherapie. |
Totale resectie is verplicht bij patiënten met subependymaal reuzencelastrocytoom. |
Everolimus wordt voorgeschreven bij diffuus subependymaal reuzencelastrocytoom. |
Piloïd astrocytoom dient na interventie met behulp van MRI te worden verwijderd om de kwaliteit van de radicale resectie van tumorweefsel te verduidelijken. |
Bij glioblastoom moet de postoperatieve behandeling (bestraling + chemotherapie) gecombineerd worden met toediening van Temozolomide. |
Bij anaplastisch astrocytoom na een operatie is radiotherapie met verdere medicamenteuze behandeling geïndiceerd. Lomustine en temozolomide worden gebruikt. |
Patiënten met anaplastisch oligodendroglioom of oligoastrocytoom krijgen na de operatie zowel bestraling als chemotherapie (temozolomide of PCV monotherapie). |
Oudere patiënten met een uitgebreid hoog-maligne glioom worden bestraald met behulp van hypofractionering, of er wordt monotherapie met Temozolomide toegepast. |
Bij recidief van het glioom worden de mogelijkheid van een heroperatie en de daaropvolgende behandelmethoden besproken in een consultatie van specialisten. Het optimale behandelschema voor recidieven: heroperatie + systemische chemotherapie + herhaalde blootstelling aan straling + palliatieve maatregelen. Bij lokale, kleine gebieden met terugkerende tumorgroei kan radiochirurgie worden toegepast. |
De medicijnen van eerste keus bij recidiverende glioomgroei zijn Temozolomide en Bevacizumab. |
Recidief van zeer kwaadaardige oligodendrogliomen en anaplastische astrocytomen is een indicatie voor behandeling met Temozolomide. |
Pleomorf xanthoastrocytoom wordt verwijderd zonder verplichte adjuvante chemotherapie. |
Een van de eigenaardigheden van gliomen is de moeilijkheidsgraad van de behandeling en verwijdering ervan. De chirurg streeft ernaar het weefsel van de tumor zo volledig mogelijk te verwijderen om de aandoening te compenseren. Veel patiënten kunnen hun levenskwaliteit verbeteren en verlengen, maar bij zeer kwaadaardige tumoren blijft de prognose ongunstig: er is een verhoogde kans op hergroei van de pathologische focus.
Voeding voor glioom van de hersenen
Dieet voor patiënten met kwaadaardige tumoren is een belangrijk punt waar helaas veel mensen weinig aandacht aan besteden. Dankzij een aangepast dieet is het echter mogelijk om de ontwikkeling van gliomen te vertragen en de verzwakte immuniteit te versterken.
Belangrijkste aspecten van dieetverandering:
- Normalisatie van metabolische processen, versterking van de immuunbescherming;
- Ontgifting van het lichaam;
- Optimalisatie van het energiepotentieel;
- Ervoor zorgen dat alle organen en systemen in het lichaam normaal kunnen functioneren tijdens zo'n moeilijke periode.
Een rationeel en evenwichtig dieet is noodzakelijk voor patiënten met vroege stadia van laag-maligne neoplasmata en patiënten met het laatste stadium van glioblastoom. Een zorgvuldig samengesteld dieet draagt bij aan een beter algemeen welzijn en herstel van beschadigd weefsel, wat vooral belangrijk is tegen de achtergrond van cytostatica en radiotherapie. Een evenwichtige samenstelling van voedingscomponenten en een goede stofwisseling voorkomen de vorming van infectiehaarden, blokkeren ontstekingsreacties en voorkomen uitputting van het lichaam.
De volgende voedingsmiddelen en dranken worden aanbevolen bij een hersenglioom:
- Rode, gele en oranje gekleurde groenten en fruit (tomaten, perziken, abrikozen, wortels, bieten, citrusvruchten) bevatten carotenoïden, die gezonde cellen beschermen tegen de negatieve effecten van radiotherapie;
- Kool (bloemkool, broccoli, spruitjes), radijs, mosterd en andere plantaardige producten die indool bevatten, een actieve stof die schadelijke toxische en chemische factoren neutraliseert;
- Groenten (dille, peterselie, jonge paardenbloem- en brandnetelblaadjes, rabarber, rucola, spinazie), groene erwten en asperges, aspergebonen en algen (zeewier, spirulina, chlorella);
- Groene thee;
- Knoflook, ui en ananas hebben een antitumor- en ontgiftende werking;
- Zemelen, granen, volkorenbrood, gekiemde peulvruchtspruiten, granen en zaden;
- Donkere druiven, frambozen, aardbeien, bosbessen, bramen, granaatappels, aalbessen, zwarte bessen, lijsterbessen, blauwe bessen, duindoorn, kersen en andere bessen die natuurlijke antioxidanten bevatten die de negatieve effecten van vrije radicalen, virussen en kankerverwekkende stoffen verminderen;
- Magere zuivelproducten.
Je moet het spijsverteringsstelsel en het hele lichaam niet belasten met zwaar en vet voedsel. Het is nuttig om versgeperste, zelfgemaakte sappen, smoothies en hapjes te gebruiken. Bronnen van omega-3-vetzuren, zoals visolie, lijnzaadolie of lijnzaad, moeten aan gerechten worden toegevoegd.
Suiker en snoep kun je beter helemaal vermijden. Maar een lepel honing met een kopje water kan geen kwaad: bijenproducten hebben een uitgesproken ontstekingsremmende, antioxiderende en antitumorwerking. De enige contra-indicatie voor het gebruik van honing is een allergie voor het product.
Uit het dieet moeten worden uitgesloten:
- Vlees, reuzel, orgaanvlees;
- Boter, vette zuivelproducten;
- Gerookt vlees, worst, vlees in blik en vis;
- Alcohol in welke vorm dan ook;
- Snoepgoed, gebak, taarten en gebakjes, snoepjes en chocolade;
- Kant-en-klaarmaaltijden, fastfood, snacks;
- Gefrituurd voedsel.
U dient dagelijks voldoende groente, bladgroenten, fruit en schoon drinkwater te eten.
Tijdens en enige tijd na de chemotherapie moet u zelfgemaakte groente- en fruitsappen drinken, magere kwark, melk en kaas eten. Het is belangrijk om voldoende te drinken, uw tanden te poetsen en uw mond regelmatig te spoelen (ongeveer 4 keer per dag).
Optimale maaltijden voor patiënten met een hersenglioom:
- Groenteschotels;
- Bijgerechten en soepen van granen (bij voorkeur boekweit, havermout, rijst, couscous, bulgur);
- Gestoomde cheesecakes, puddingen, ovenschotels;
- Gestoofde en gebakken groenten;
- Stoofschotels, groentesoepen, voorgerechten en hoofdgerechten van peulvruchten (inclusief soja), patés en soufflés;
- Smoothies, groene thee, compotes en hapjes.
Het voorkomen
Als iemand een gezonde levensstijl leidt en er onder zijn familieleden geen gevallen van kanker voorkomen, heeft hij een grote kans om geen hersenglioom te krijgen. Er is geen specifieke preventie tegen dergelijke tumoren, dus de belangrijkste preventiepunten zijn goede voeding, lichaamsbeweging, het vermijden van slechte gewoonten en het vermijden van beroeps- en huishoudelijke risico's.
Specialisten geven een aantal eenvoudige, maar effectieve aanbevelingen:
- Drink meer puur water en vermijd gezoete frisdranken, verpakte sappen, energiedrankjes en alcohol.
- Vermijd beroeps- en huishoudelijke gevaren: minder contact met chemicaliën, bijtende oplossingen en vloeistoffen.
- Probeer eten te bereiden door te koken, stoven, bakken, maar niet door te frituren. Geef de voorkeur aan gezonde, kwalitatieve, zelfgemaakte gerechten.
- Een groot deel van uw dieet moet bestaan uit plantaardige voeding, waaronder bladgroenten, ongeacht de tijd van het jaar.
- Een andere negatieve factor is overgewicht, waar je vanaf moet komen. Gewichtsbeheersing is erg belangrijk voor de gezondheid van het hele lichaam.
- Plantaardige oliën verdienen altijd de voorkeur boven boter en reuzel.
- Indien mogelijk is het wenselijk om de voorkeur te geven aan milieuvriendelijke producten, vlees zonder hormonen, groenten en fruit zonder nitraten en pesticiden. Het is beter om rood vlees helemaal te vermijden.
- Neem geen multivitaminepreparaten zonder indicatie en in grote hoeveelheden. Neem geen medicijnen zonder doktersrecept: zelfmedicatie is vaak zeer gevaarlijk.
- Als er verdachte symptomen optreden, is het noodzakelijk om een arts te raadplegen, zonder te wachten tot de situatie verergert en er zich bijwerkingen en complicaties voordoen.
- Snoepgoed en voedingsmiddelen met een hoge glycemische index vormen een ongewenst onderdeel van de voeding.
- Hoe eerder iemand naar de dokter gaat, hoe groter de kans op genezing (en dit geldt voor bijna alle ziekten, dus ook voor gliomen in de hersenen).
Om de vorming van oncopathologie te voorkomen, moet u voldoende tijd hebben om te slapen en te rusten, overmatige consumptie van alcoholische dranken vermijden, de voorkeur geven aan hoogwaardige natuurlijke voeding en het gebruik van gadgets (met name mobiele telefoons) beperken.
Tumorziekten komen vaak voor bij ouderen. Het is daarom belangrijk om al op jonge leeftijd je eigen gezondheid in de gaten te houden en geen pathologische processen te veroorzaken door een ongezonde levensstijl en ongezonde gewoonten.
De exacte grondoorzaken van oncologie zijn nog niet opgehelderd. Een zekere rol spelen echter natuurlijk ongunstige werk- en omgevingsomstandigheden, blootstelling aan ioniserende en elektromagnetische straling en hormonale veranderingen. Vermijd langdurig en regelmatig verblijf in de zon, sta plotselinge temperatuurschommelingen toe, oververhitting in bad of sauna, en neem regelmatig hete baden of douches.
Een andere vraag: hoe voorkom je dat een hersenglioom terugkeert na een succesvolle behandeling? Terugkeer van neoplasmagroei is een complexe en helaas frequente complicatie die moeilijk vooraf te voorspellen is. Patiënten kunnen worden geadviseerd om regelmatig preventief onderzoek en controles te ondergaan, minstens twee keer per jaar een oncoloog en behandelend arts te bezoeken, een gezonde levensstijl te leiden, gezond en natuurlijk te eten en matig te bewegen. Andere voorwaarden zijn levenslust, gezond optimisme en een positieve houding ten opzichte van succes, ongeacht de omstandigheden. Dit omvat ook een vriendelijke sfeer binnen het gezin en op het werk, geduld en onvoorwaardelijke steun van naasten.
Prognose
De toestand van de hersenen en de kenmerken van het glioom ten tijde van de detectie beïnvloeden de overlevingskans evenzeer als de toegepaste behandeling. Een bevredigende algemene gezondheidstoestand van de patiënt en zijn leeftijd verbeteren de prognose (de prognose is optimistischer bij jonge patiënten). Een belangrijke indicator is het histologische beeld van het neoplasma. Zo hebben laaggradige gliomen een betere prognose dan anaplastische gliomen en, nog meer, glioblastomen (de meest ongunstige tumoruitlopers). Astrocytomen hebben een slechtere prognose dan oligodendrogliomen.
Maligne astrocytomen reageren slecht op therapie en hebben een relatief lage overlevingskans van zes tot vijf jaar. Tegelijkertijd wordt de levensverwachting bij laaggradige gliomen geschat op 1-10 jaar.
Maligne astrocytomen zijn in principe ongeneeslijk. De behandeling richt zich meestal op het verminderen van neurologische manifestaties (waaronder cognitieve disfunctie) en het verhogen van de levensverwachting met behoud van de hoogst mogelijke kwaliteit van leven. Symptomatische therapie wordt toegepast tegen de achtergrond van revalidatiemaatregelen. De expertise van een psycholoog is eveneens belangrijk.
In het afgelopen decennium hebben wetenschappers enige vooruitgang geboekt in hun begrip van de aard van hersentumoren en de behandeling ervan. Er moet nog veel meer worden gedaan om de prognose van de ziekte te optimaliseren. De belangrijkste taak van specialisten is tegenwoordig: hersengliomen moeten verschillende behandelmethoden hebben om het probleem effectief en in één keer te elimineren, zowel in de vroege als in de latere stadia van de ontwikkeling.

